Metoda telemetryczna w badaniach owadów i płazów
Jedną z terenowych metod badań, dających najwięcej informacji o życiu dzikich zwierząt, jest telemetria (technika dokonywania pomiarów na odległość). Polega ona na śledzeniu zwierząt zaopatrzonych w nadajniki radiowe, które dokonują pomiaru wybranej wielkości oraz automatycznego przesyłu danych drogą radiową do centrali.
Dzięki postępowi techniki obecnie stosowane nadajniki zostały zminiaturyzowane i ich waga stanowi jedynie niewielki procent wagi ciała zwierząt. Poza tym, dzięki zastosowaniu ogniw litowych, mogą one pracować nawet do trzech lat, bez konieczności wymiany baterii. Technika telemetrii pozwala na zdobywanie informacji o zwierzętach praktycznie bez ingerencji w ich życie. Namiary prowadzone są z dużej odległości, dzięki czemu zwierzęta nie są nawet świadome obecności obserwatora. Dzięki badaniom telemetrycznym możemy dowiedzieć się nie tylko na jakim obszarze zwierzęta się poruszają i jak daleko wędrują, ale także czym i jak często się odżywiają, jak wygląda ich cykl aktywności dobowej, jak kontaktują się z innymi osobnikami swojego gatunku, jak się rozmnażają.
Techniki telemetryczne
A) Implanty zewnętrzne
I. Płazy bezogonowe
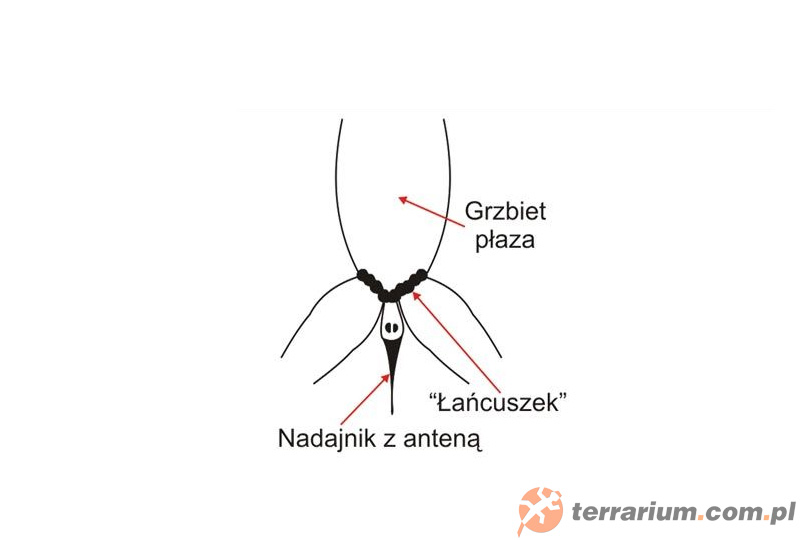
Skóra płazów jest delikatna i śliska, co utrudnia zakładanie nadajników. Urządzenia wykonane są z elastycznej uprzęży, ślizgającej się po skórze (dopasowanie do kształtu ciała) i nadajnika przymocowanego do uprzęży. Całość waży 2 g. Dwóch ludzi zakłada nadajnik (jedna osoba trzyma zwierzę, a druga zakłada uprząż). Urządzenie jest założone dobrze wtedy, gdy uprząż ślizga się po skórze i nieznacznie uciska wyższe mięśnie kończyn tylnych. Proces znakowania trwa 5 minut, co ogranicza stres płaza. Pasek podlega korozji i po jakimś czasie musi być wymieniony. Kiedy u płazów wystąpi wzrost lub spadek przyrostu masy mięśni nóg, wtedy kilka kulek paska jest dodawanych lub odejmowanych, aż do uzyskania optymalnego dopasowania. Paski zbyt luźne są często zrzucane, a zbyt ściśnięte kaleczą zwierzę. Zasięgi występowania płazów określone przy pomocy telemetrii to ok. 100 m na lądzie i 5 m pod wodą.
Wystające części nadajników muszą być małe, aby umożliwić płazom odwracanie w szczelinach skalnych i tunelach.
Wady telemetrii:
- wyczerpanie baterii
- uszkodzenie nadajnika (woda przenika do środka)
- korozja pasków (zerwanie)
- okaleczenie płaza
- zrzucenie pasków (luźne)
- brak zasięgu (płazy opuściły teren badań lub zostały zjedzone przez drapieżniki – czapla biała, szop pracz, jeden nadajnik znaleziony w gnieździe jastrzębia)
Zalety telemetrii:
- ocena zasięgu występowania osobników
- ograniczenie stresu płazów (krótki czas zakładania nadajników)
- ograniczenie ingerencji człowieka w życie płazów
- niewielkie szanse na zranienie żab
II. Owady
Metody telemetryczne badano nie tylko u kręgowców, ale też u bezkręgowców. Telemetria jest szczególnie przydatna w warunkach dużego zagęszczenia roślin (lasy, żywopłoty), ponieważ fale radiowe przenikają przez gęstą roślinność. Drugą zaletą telemetrii jest to, iż kilka osobników może być obserwowanych jednocześnie dzięki unikalnym sygnałom używanym dla każdego z nich. Skuteczność tej metody zależy od gatunku i środowiska w którym występuje. Metodę tą stosowo do badań sposobów poruszania się pszczół, trzmieli, krabów i pająków. Obiektem badań, które opiszę był chrząszcz (pachnica dębowa) (chrząszcz z rodziny Cetoniidae) żyjący w pniach drzew (gł. dębów) i przemieszczający się na krótkie odległości.
Oznaczonych nadajnikami radiowymi (waga 0.48-0.52 g ) zostało 74 (34 samice, 40 samców) dorosłych chrząszczy. Nadajniki teoretycznie nie ograniczały ich lotu, choć wydaje się to mało prawdopodobne. Żywotność baterii wynosiła od 12 do 20 dni. Rozproszenie odgrywa ważną rolę w biologii populacji owadów. Badania telemetryczne u Osmoderma eremita miały na celu określenie potrzeb środowiskowych, dynamiki populacji i rozproszenia (zdolność dyspersji) tego gatunku. Osobniki wybrane do badań pochodziły z zebranych w próchnie i hodowanych w sztucznych warunkach larw, dlatego imagines miały większe, niż przeciętne masy ciała. Każdego owada charakteryzował indywidualny sygnał docierający do radioodbiornika, dzięki czemu można było odróżnić poszczególne osobniki. Nadajniki były przyklejone do przedplecza owada. Ich lokalizację sprawdzano raz dziennie. Obserwacje rozpoczynano w miejscu, gdzie poprzedniego dnia określono pozycję danego owada. Sygnał odbierany był szybko, gdy chrząszcz znajdował się blisko. Z kolei, gdy był on daleko wyłapanie sygnału rozpoczynało się kierowaniem radioodbiornika we wszystkie kierunki. Zasięg odbierany był z odległości 50 do 100m. Najdłuższy określony zasięg to 330m (z których 280m stanowiło otwarte pole). Zasięg wykrywania był utrudniony po deszczu i w czasie, gdy chrząszcze chowały się w szczelinach, ale w czasie słonecznej pogody łatwo był odzyskiwany. Strata kontaktu wywołana była zazwyczaj wyczerpaniem baterii, rozbiciem anteny lub uszkodzeniem nadajnika pod wpływem wilgoci. Więcej kontaktów zostało zerwanych w przypadku samic, niż samców, wywołane jest to odmiennym zachowaniem obu płci (samice częściej kopią w próchnie podczas składania jaj i nadajnik lub antena może zostać uszkodzona, a baterie mogą zostać zniszczone pod wpływem wilgoci). Badania telemetryczne są bardzo pomocne przy określaniu migracji organizmów. Zmniejszając masę nadajników i zwiększając elastyczność anten można rozszerzyć zakres badań na inne, jeszcze mniejsze zwierzęta.
B) Implanty wewnętrzne
I. Płazy
Implanty chipowe umieszczane są w brzusznej jamie ciała płaza po ogólnym znieczuleniu 0,1% 2-fenoksyetanolem. Zwierzę budzi się po 10-30 minutach. Implant powinien być mały, aby umożliwić zwierzęciu poruszanie w wąskich przestrzeniach. Implanty muszą być pokryte parafiną, która zapobiega odrzuceniu przez system immunologiczny. Szew nie może być większy niż 1mm, aby mechanizmy fizjologiczne zwierzęcia szybko zamknęły ranę. Zwierzęta muszą być wypuszczane po dwóch dniach od złapania i w miejscu ich schwytania. Wtedy przy użyciu komputerów analizuje się wyniki radiotelemetryczne przesyłane przez implanty.
Oprócz telemetrii stosuje się również inne metody znakowania płazów:
1. Metoda obcinania paliczków I fluorescencyjna
I. Płazy
Metody znakowania płazów są różne, ale nie istnieje żadna uniwersalna. Obcinanie paliczków płazom (toe-clipping) jest metodą niedrogą i prostą w zastosowaniu. Chcąc stosować tę metodę, musimy przygotować odpowiednio palec do obcięcia i zachować sterylność. Metodą tą można nacechować indywidualnie 9999 lub 39999 osobniki. Każdy osobnik nacechowany jest na całe życie.
Alternatywą znakowania mogą być metody fluorescencyjne. Wprowadzanie do organizmu fluorescencyjnego proszku było stosowane u salamander i żab Eleutherodactylus podiciferus. Proszek wstrzykiwano do tylnej kończyny płaza pod wpływem wysokiego ciśnienia. Obydwie metody porównywano pod względem: dostarczonego stresu, przetrwania, długowieczności znaku oraz kosztów stosowania wybranej metody.
Metoda obcinania paliczków:
- możliwość pojawienia się infekcji (rzadko)
- krótki czas znakowania (ograniczony stres)
- sprzęt niezbędny do znakowania jest lekki i tani
- metoda łatwa do zastosowania
- znak widoczny przez długi okres (paliczki nie mają zdolności regeneracji- wyjątek: kumaki i traszki)
- nie stwierdzono zmian zachowań u żab i wpływu na ich rozwój, przeżywalność i wzrost
Metoda fluorescencyjna:
- czasochłonna do aplikacji (wzrost stresu)
- wybuch powietrza o podwyższonym ciśnieniu może ogłuszać żaby (większe żaby są odporniejsze)
- sprzęt niezbędny do znakowania jest ciężki i drogi
- metoda trudniejsza do zastosowania
- znaki dobrze widoczne (szczególnie pod wpływem UV)
- proszek nie wpływa na tkanki organizmu
Pomarańczowe i żółte pigmenty fluorescencyjne mogą być wykorzystywane do śledzenia zwierząt w środowisku. Pigmenty są rozpuszczane w oleju parafinowym, do uzyskania nieprzeźroczystej, jednolitej farby. Następnie farbą maluje się spodnią stronę kończyn ropuch. Następnej nocy można obserwować (lampa UV) ślady pozostawione przez zwierzęta. Ślady są wykrywane przez kilka dni, a ich zasięg obejmuje od 3,1 do 73m. Metoda jest niedroga i łatwa w zastosowaniu.
Telemetria umożliwia odnalezienie pojedynczego osobnika i ponowne jego oznakowanie pigmentem. Stosowanie tych dwóch metod jednocześnie umożliwia uzyskanie dokładniejszych wyników.
| Warunki mikroklimatyczne | |||
| Radiotelemetria chipowa (codzienna obserwacja) | Pigment fluorescencyjny | Obie metody | |
| Zachowanie i ekologia | |||
| Aktywność dobowa | +++ | nieskuteczny | – |
| Przywiązanie do miejsca | ++ | ++ | +++ |
| Zasięg występowania | + do ++ | +++ | +++ |
| Migracja i rozproszenia | |||
| Wzór śladu przestrzennego | ++ | +++ | +++ |
| Wzór śladu czasowego | ++ | + | ++ |
| Środowisko | |||
| Opis środowiska | +++ | +++ | +++ |
| Jamy, nory | +++ | ++ | +++ |
| Ścieżki | + | +++ | +++ |
| Ruchy w wodzie | ++ | nieskuteczny | – |
Tab.1. Porównanie skuteczności dwóch metod: radiotelemetrycznej (implanty chipowe) i fluorescencyjnej (pigmenty pod kończynami); [+mało informacji, ++dużo informacji, +++bardzo dużo informacji] (za Eggard C. Peyred P. Guyetant R. 1999)
2. Metoda pattern mapping
I. Płazy
Traszki i kumaki mają zdolność do regeneracji utraconych części ciała. Płazów tych nie oznaczamy poprzez obcinanie paliczków, lecz fotografujemy stronę brzuszną (pattern mapping), na której układ plam jest indywidualny i nie ulega zmianie w czasie rozwoju osobnika.
3. Metoda obcinania fragmentu ogona kijanki
I. Płazy
Jeśli chcemy policzyć ile kijanek znajduje się w zbiorniku wodnym, obcinamy ok. 1/3 długości ogona i wypuszczamy zwierzęta z powrotem. Obcięty ogon stopniowo regeneruje się, ale nie osiąga już pierwotnej wielkości i kształtu. Przy powtórnych odłowach, po ok. 10 dniach, łatwo możemy odróżnić oznaczone wcześniej osobniki od larw nieoznakowanych.
Płazy są małymi zwierzętami, co stanowi ograniczenie techniczne. Wybór odpowiedniej metody zależny jest także od celu badania, skuteczności metody, a przede wszystkim od bezpieczeństwa zwierzęcia.
Opracowanie i źródła informacji
Opracowała Kornelia Orczyk na podstawie literatury:
Berger L. 2000. Płazy i gady Polski; Warszawa-Poznań 149 s.
Eggard C. Peyred P. Guyetant R. 1999. Two complementary methods for studying amphibian terrestial movements. Current Studies in Herpetalogy-Chambery. 95-97.
Hedin J., Ranius T. 2002. Using radio telemetry to study dispersal of the beetle Osmoderma eremita, an inhabitant of tree hollows. Computers and Electronics in Agriculture 35: 171-180.
Madison D. M. 2003. Radio-tracking Amphibians: Lessons from Implant and External Attachment Procedures. www.npwre.usgs.gov/resource/tools/telemetry/amphibia.htm
Rathbun G. B. Murphey T. G. 1996. Evaluation of Radio-belt for Ranid frogs. Herpatological Review 27(4):
Schlaepfer M. A. 1998. Use of a Fluorescent Marking Technique on Small Terrestial Anurans. Herpatological Review 29(1):25-26.
Liczba wyświetleń: 3388






















 [5]
[5]