W ostatnich latach obserwuje się spadek liczebności płazów, a jego przyczyny nie są do końca poznane (Collins i Storfer 2003). Przypuszcza się, że na obniżenie liczebności tych kręgowców wpływa wiele czynników, których negatywne działania kumulują się.
Jednym z takich czynników są pasożyty żab, które mogą przyczyniać się m.in. do deformacji ciała osobników (np. deformacje kończyn i warg), co utrudnia poruszanie się oraz pobieranie pokarmu (Sessions i Ruth 1990; Johnson i In. 1999). Helmintofauna może zasiedlać również narządy wewnętrzne, co powoduje obniżenie kondycji osobników i zmniejszenie ich szans na przeżycie i rozród.
W tym roku miałam możliwość uczestniczenia w badaniach prowadzonych przez Zakład Ekologii Uniwersytetu Warszawskiego, dotyczących min. pasożytów występujących u żab moczarowych- Rana arvalis.
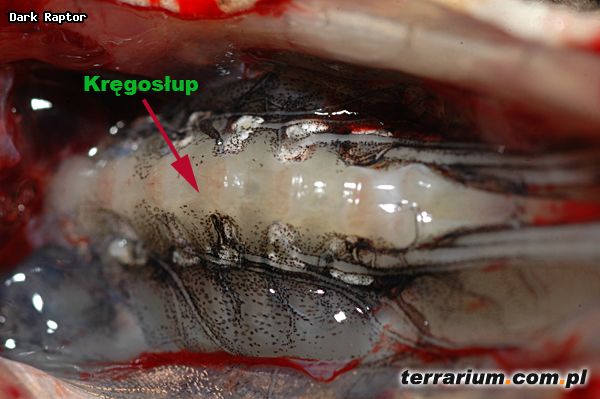
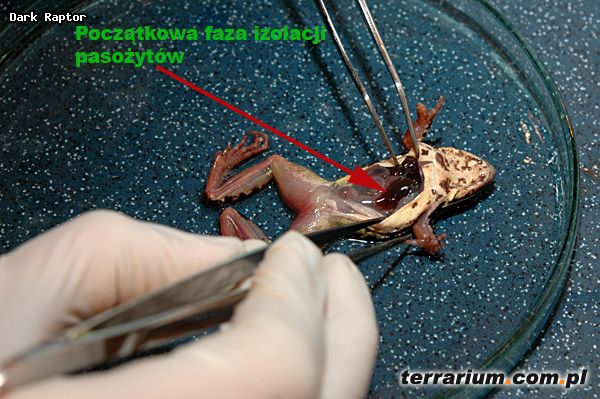
Wszystkie pasożyty były izolowane z organizmów schwytanych żab. Gatunek ten posiada delikatną budowę ciała, zaostrzony pysk oraz jeden duży, twardy modzel podeszwowy z krawędzią wyraźnie wystającą poza profil kończyny. Samce tego gatunku zmieniają ubarwienie skóry, na intensywnie niebieskie, w okresie rozrodczym (Juszczyk 1974). Cechy te pozwalają na łatwą identyfikację starszych osobników.
Zwierzęta użyte do badań odławiano w okolicach Stacji Terenowej Instytutu Zoologii Uniwersytetu Warszawskiego w Urwitałcie na Pojezierzu Mazurskim (okolice Jeziora Łuknajno). Poławiano tylko żaby brunatne Rana arvalis, które zasiedlały płytkie zbiorniki wodne. Wzdłuż brzegów zbiorników oraz na stanowiskach nieznacznie od nich oddalonych (np. łąki, las olchowy) rozstawiono płotki liniowe i krzyżowe. Ogrodzenia wykonane były z czarnej folii, a na ich końcach wkopano w ziemię wiadra z niewielką ilością wody. Zwierzęta przemieszczając się natrafiały na przeszkodę (płotek) i kierowały się wzdłuż niej, a następnie wpadały do wiader.
Wybrane losowo zwierzęta były usypiane za pomocą MS222 (3-aminobenzoic acid ethyl ester), w celu pobrania pasożytów z ich organizmów.
Lokalizacja pasożytów w ciele żywiciela wiąże się z rodzajem pasożytnictwa:
A) pasożytnictwo zewnętrzne- pasożyty zasiedlają powierzchnię ciała gospodarza (np. skórę) lub jego jamy, które mają kontakt ze środowiskiem zewnętrznym (np. jamy nosowe, zewnętrzny przewód słuchowy, jamy skrzelowe u kijanek). Pasożyty zewnętrzne (np. roztocze, pijawki, owady, przywry monogeniczne) często posiadają narządy czepne, które ułatwiają zakotwiczenie na powierzchni gospodarza.
B) Pasożytnictwo wewnętrzne- pasożyty zasiedlają wnętrze organizmu żywiciela (narządy wewnętrzne, tkanki, komórki). Helmintofauna (np. przywry monogeniczne, tasiemce, kolcogłowy, nicienie) ta również może posiadać narządy czepne, lub ich całkowity brak.
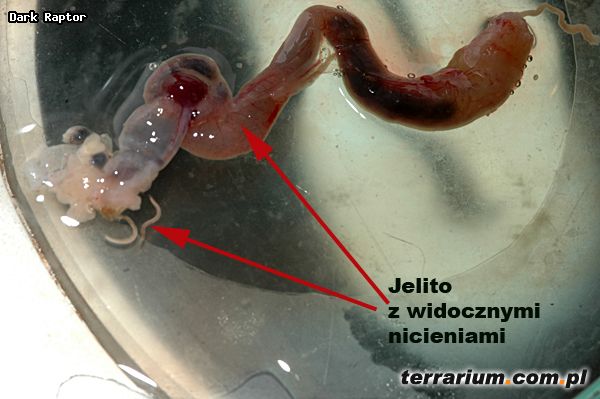
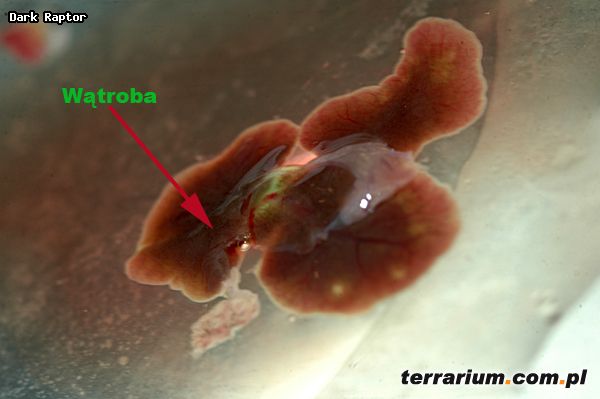
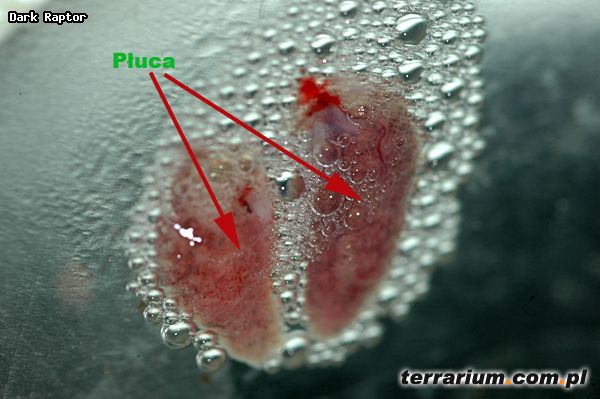
Wszystkie pasożyty pobierano z: jamy gębowej, jamy ciała, serca, wątroby, płuc, nerek, pęcherza moczowego, ciała tłuszczowego, żołądka i jelit oraz jajowodów u samic.
Pozyskaną helmintofaunę umieszczano w ependorfach z 96% alkoholem etylowym, w którym można przechowywać większość martwych organizmów, na których przeprowadzanie badań planowane jest w późniejszym terminie.
W następnej kolejności utrwalano pobrane pasożyty poprzez trzymanie ich przez 24 godziny w AFI-e (Alcohol Formalin-Acetic Acid). Związek ten zawiera 40%-ową formalinę, 96%-owy etanol, glicerynę, kwas octowy oraz wodę destylowaną. Pobrane próbki umieszcza się pomiędzy dwoma szkiełkami podstawowymi, a następnie ściska gumką i umieszcza w zbiorniku (kominku) z AFI-ą. Przywry z płuc umieszcza się tylko na pół godziny w AFI-e ponieważ są bardzo delikatne i łamliwe.
Następnie po wyjęciu utrwalonych już przywr i ich jaj z kominków, organizmy wybarwia się w następującej kolejności:
1. Barwienie: moczenie w karminie boraksowym przez 24 godziny, aż do uzyskania ciemnofioletowego koloru.
2. Odbarwianie: moczenie w 75%-owym kwaśnym etanolu, aż do momentu pojawienia się jaśniejszych i ciemniejszych fioletowych odcieni, wówczas stają się lepiej widoczne narządy wewnętrzne pasożytów.
3. Odwadnianie: moczenie po kolei w szeregu alkoholi etylowych o różnym stężeniach, poczynając od 75%-owego, przez 80%, 85%, 90%, 95%, oraz dwukrotnie w alkoholu absolutnym 99,8%. W każdym alkoholu preparat był moczony przez 10-15 minut.
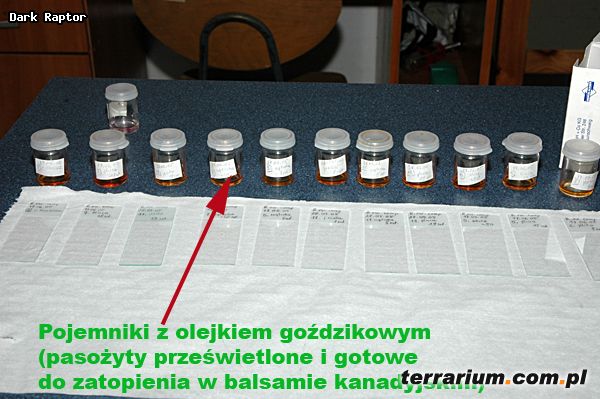
4. Utrwalanie: moczenie przez 24 godziny w olejku goździkowym, który zwiększa przejrzystość preparatu (proces prześwietlenia).
Podczas każdorazowej wymiany kolejno następujących po sobie związków odsącza się poprzedni za pomocą pipety i wlewa się inny (nie wyjmując okazów ze słoiczków). Wszystkie etapy wybarwiania przeprowadza się w tym samym dla każdego okazu słoiczku.
Wybarwione okazy są przenoszone na szkiełka podstawowe, zalewane balsamem kanadyjskim i przykrywane szkiełkiem nakrywkowym. Liczba okazów na szkiełku zależy od ich wielkości. Na jednym może znajdować się od 1 do 8 pasożytów lub tkanek z jajami przywr.
W następnej kolejności preparat jest odkładany na 48 godzin do wyschnięcia. Różne pasożyty umieszczone na gotowych już preparatach oznacza się do poziomu gatunku lub rodzaju.
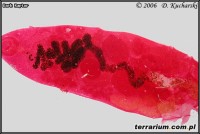
Najwięcej pasożytów stwierdziłam w jamie gębowej (przywry), jelitach (głównie nicienie i przywry), płucach (głównie nicienie i przywry). Zauważyłam, że często przy obecności przywr w płucach nie występowały w nich nicienie i odwrotnie. Mniej liczną helmintofaunę zaobserwowałam w innych narządach wewnętrznych i tkankach. Gatunki pasożytów pozyskanych z ciał żab nie zostały jeszcze oznaczone.
Oprócz przywr wyizolowano z organizmów płazów różne gatunki nicieni. Pasożyty te nie przechodzą procesu barwienia ponieważ ich żółta kutikula jest dobrze widoczna na preparatach. Mogą być one utrwalane w 70%-owym etanolu z kroplą glicerolu. Przez kilka kolejnych dni dodaje się po kropli glicerolu do probówek w celu prześwietlenia okazów. Po wyparowaniu alkoholu nicienie przenosi się na szkiełka podstawowe i następnie wykonuje się preparaty stałe (identycznie jak u przywr).
Również kolcogłowy nie są poddawane procesowi barwienia ze względu na słabą przenikliwość barwnika do ryjka z hakami (cecha diagnostyczna). Organizmy te przeprowadza się przez szereg alkoholi o różnych stężeniach procentowych, a następnie prześwietla w olejku goździkowym i sporządza preparat stały. Wśród żab, z których izolowałam pasożyty nie stwierdziłam obecności kolcogłowów oraz tasiemców.
Jak widać życie wewnętrzne płazów może być bardzo bogate, a techniki służące jego poznaniu dość skomplikowane. Dzięki analizom parazytologicznym jesteśmy w stanie ocenić stan zdrowotny populacji żab na różnych etapach aktywności (migracje, rozród, zimowanie). Badania pozwalają zapełnić lukę w naszym stanie wiedzy, dotyczącą wpływu pasożytów na zachowanie swoich gospodarzy oraz jednej z przyczyn spadku liczebności płazów.
Więcej informacji na temat pasożytów występujących u płazów, opisałam w artykule, pt. Pasożyty zwierzęce płazów (wybrane grupy pasożytów)
Pokrewna tematyka:
Nicienie entomopatogenne
Opracowała Kornelia Kucharska na podstawie literatury:
Collins J. P., Storfer A., 2003: Global amphibians declines: sorting hypotheses. Diversity and Distributions, 9: 89-98.
Johnson P. T., Lunde K. B., Ritchie E. G., Launer A. E., 1999: The effect of trematode infection on amphibian limb development and survivorship. Science. 284: 802-4.
Juszczyk W., 1974: Płazy i gady krajowe. PWN, Warszawa.
Sessions S. K., Ruth S. B., 1990: Explanation for naturally occurring supernumerary limbs in amphibians. J Exp Zool. 254: 38-47.
Zdjęcia: Dariusz Kucharski i Kornelia Kucharska.
Liczba wyświetleń: 2952






















 [6]
[6]