Badanie parazytologiczne gadów
Wiele już zostało powiedziane na temat pasożytów domowych gadów, o konieczności regularnego badania kontrolnego kału, o niebezpieczeństwie związanym z nasiloną inwazją pasożytów. Często jednak pojawiają się informacje będące zlepkiem półprawd i niedomówień czy też całkowicie błędne, utarte slogany. W niniejszym artykule chciałbym zaprezentować metodykę stosowaną w badaniu parazytologicznym gadów i płazów, ale także innych zwierząt, w tym drobnych ssaków terraryjnych.
Zacznijmy od kilku podstawowych pojęć z dziedziny parazytologii. Pasożyt to organizm, który wchodząc w interakcję z innym organizmem innego, zwykle wyższego pod względem ewolucyjnym gatunku żyje jego kosztem. Ten poszkodowany organizm określany jest mianem żywiciela. Wyróżnia się dwa główne typy żywicieli: ostatecznego i pośredniego. Żywiciel ostateczny to ten, w którym pasożyt osiąga postać dorosłą i rozmnaża się w sposób płciowy. Jest ostatecznym „celem” pasożyta, stanowi jego środowisko życia. Żywiciel pośredni jest niejako „przystankiem” na drodze do żywiciela ostatecznego. Często żywiciel pośredni musi zostać zjedzony przez żywiciela ostatecznego, aby pasożyt mógł zakończyć cykl rozwojowy. Pasożyty, które posiadają tylko jednego żywiciela (ostatecznego) posiadają prosty cykl rozwojowy – jaja wydalone z kałem zostają zjedzone i to wystarczy do zamknięcia cyklu. Pasożyty o złożonym cyklu rozwojowym potrzebują minimum jednego, a czasami kilku żywicieli pośrednich. Inna, często stosowana nazwa pasożytów zasiedlających przewód pokarmowy swojego żywiciela to helminty. Pasożyty zewnętrzne, żyjące na powierzchni ciała swojego żywiciela (np. roztocza), określa się jako ektopasożyty.
Zadaniem wszystkich pasożytów jest przedłużenie istnienia własnego gatunku. Dlatego też większość pasożytów nie ma na celu szybkiego uśmiercenia swojego żywiciela ostatecznego – szkodzą mu, jednak w ograniczonym stopniu, systematycznie obniżając odporność, ale dając sobie czas na osiągnięcie dojrzałości płciowej i wydanie na świat kolejnego pokolenia. Oczywiście osłabiany przez pasożyta organizm dość szybko staje się podatny na różne infekcje czy po prostu na ataki drapieżników, jednak do tego czasu pasożyty zdążą przedłużyć istnienie gatunku.
Helminty muszą się rozprzestrzeniać. Osobnik, w którym żyją aktualnie, zgodnie z prawami natury kiedyś zakończy żywot, dlatego tak istotne jest, aby potomstwo zasiedliło innego, być może młodszego osobnika. Najprostszą drogą wydostania się zapłodnionych jaj/larw poza organizm aktualnego żywiciela jest ich transport z kałem i wydalenie ich wraz z nim do środowiska naturalnego. Dalsze losy pasożytów są już bardzo różnorodne i zależne od biologii helminta – niektóre pozostają w postaci jaj, biernie czekając na zjedzenie przez nowego żywiciela, inne aktywnie go poszukują, jeszcze inne przez pewien czas prowadzą niepasożytniczy tryb życia i dopiero w odpowiednim momencie wnikają do żywiciela.
W warunkach hodowlanych sytuacja ta powoduje duże zagrożenie dla naszych zwierząt, szczególnie w przypadku helmintów o prostym cyklu rozwojowym (np. kokcydia, większość owsików). Mocno ograniczony obszar przebywania żywicieli (czyli de facto obszar terrarium) prowadzi do kumulacji inwazyjnych form pasożyta (cyst lub jaj), które regularnie prowadzą do reinwazji (ponownego zakażenia). W ten sposób jedna agama, w której przewodzie pokarmowym żyła bardzo nieliczna populacja owsików, po pewnym czasie może paść z powodu bardzo silnego zarobaczenia. Inaczej jest w przypadku gatunków o złożonym cyklu rozwojowym, potrzebującym żywicieli pośrednich, z którymi w praktyce lekarskiej spotykamy się zdecydowanie rzadziej, głównie w przypadku osobników importowanych z natury.
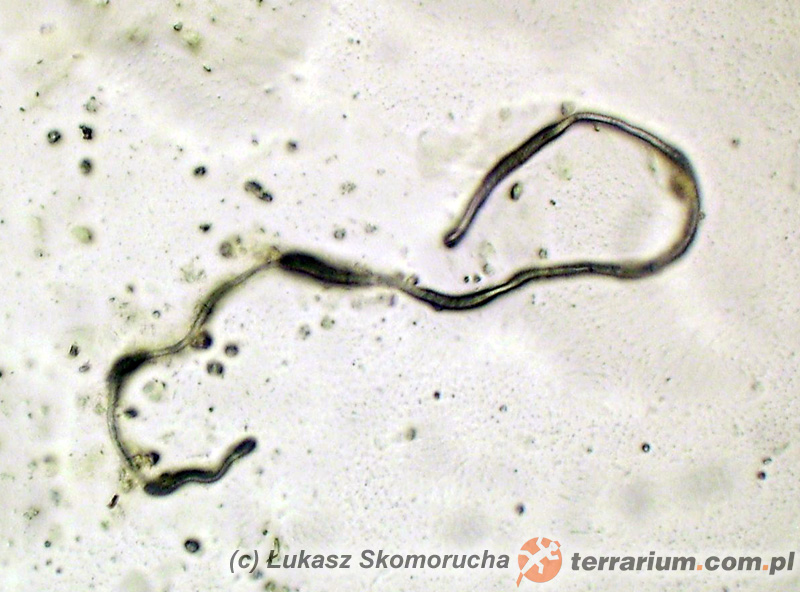
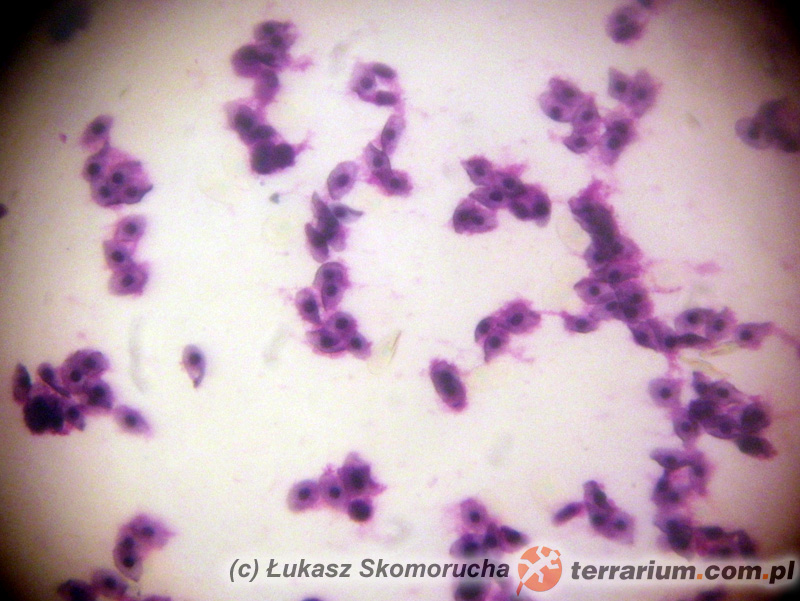
Dla potwierdzenia lub wykluczenia inwazji helmintów najlepszym (i właściwie jedynym logicznym) materiałem do badań jest kał. W przypadku podejrzenia inwazji pasożytów innych układów wykorzystuje się inny materiał badawczy, np. mocz. Tak jest w przypadku Capillaria plica, nicienia bardzo rzadko notowanego w Polsce u psów, Eimeria truncata – pierwotniaka z grupy kokcydiów zasiedlającego nerki gęsi, a spośród zwierząt nas interesujących: przywr z rodzaju Styphlodora czy pierwotniaka Hexamita parva. Te pierwsze pasożytują w nerkach dużych dusicieli (pytony, boa), jednak mają złożony cykl rozwojowy (potrzebują dwóch żywicieli pośrednich), dlatego w warunkach hodowlanych nie odgrywają znaczącej roli. Inaczej jest w przypadku H.parva, który może stanowić poważne zagrożenie dla zdrowia, a nawet życia młodych żółwi (zobacz: Heksamitaza żółwi). Pasożyty krwi stwierdza się poprzez wykonanie rozmazu kilku kropli krwi na szkiełku podstawowym i wybarwieniu go odpowiednimi odczynnikami tak, by komórki krwi i pasożyty stały się wyraźne i dobrze widoczne. Badanie to nie jest zbyt popularne, głównie ze względu na brak danych odnośnie występowania pasożytów krwi u domowych gadów. Z pewnością grupą podwyższonego ryzyka są gady i ssaki importowane do Polski z odłowu lub ferm hodowlanych w krajach o klimacie tropikalnym. Jednak i na terenie Polski występują rodzime pasożyty krwi gadów, zasiedlające naturalnie krajową herpetofaunę. Nie da się w 100% wykluczyć możliwości przeniesienia ich na osobniki hodowane w domach, szczególnie jeśli te mają dostęp do wybiegów zewnętrznych w okresie letnim. Ektopasożyty zwykle stwierdza się poprzez oglądanie zwierząt (prawie zawsze pasożytnicze stawonogi są na tyle duże, że da się je zauważyć gołym okiem) lub poprzez wykonanie zeskrobiny ze skóry, co jest szczególnie przydatne w przypadku gryzoni i innych owłosionych ssaków.
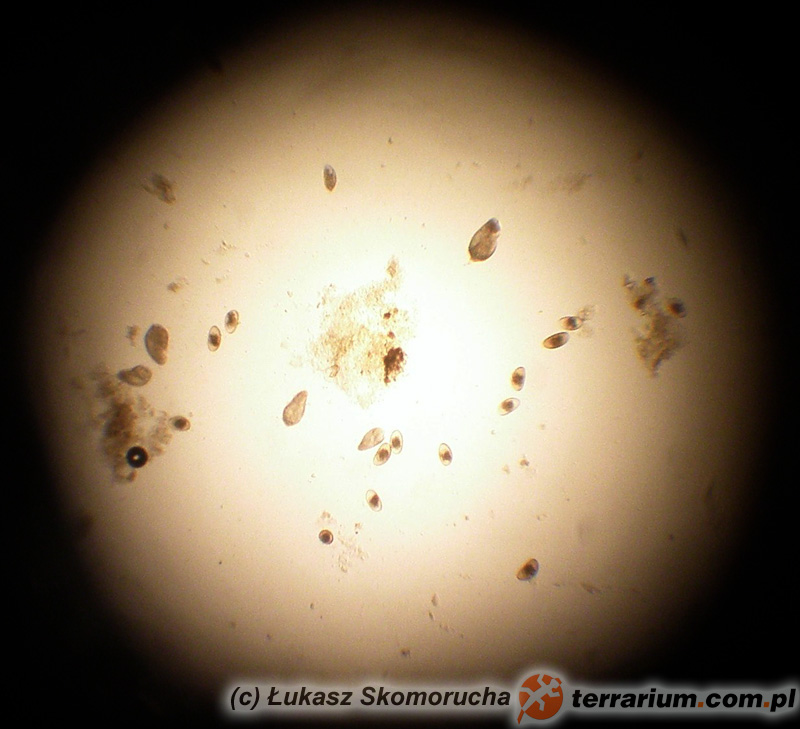
Skupmy się na badaniu parazytologicznym kału, czyli de facto najczęściej wykonywanym badaniu. Generalnie można je przeprowadzić w trojaki sposób:
- Najprostszą metodą jest bezpośredni rozmaz kału. Na szkiełko podstawowe nanosi się cienką warstwę kału, ewentualnie delikatnie rozcieńcza odrobiną sterylnej soli fizjologicznej i ogląda pod mikroskopem pod różnymi powiększeniami. W określonych przypadkach można zastosować dodatkowo barwienia specjalnymi odczynnikami, aby lepiej uwidocznić pasożyty
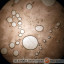
- Flotacja jest metodą szczególnie przydatną przy wykrywaniu pasożytów u ssaków, jednak często stosowana jest także wobec materiału pochodzącego od gadów. Polega na rozmieszaniu próby kału z przesyconym roztworem soli lub cukru. Próba jest pozostawiona do odstania na kilkanaście minut. Ciężar właściwy jaj pasożytów powoduje ich „wypchnięcie” ku powierzchni roztworu i przyklejenie się do spodniej strony szkiełka nakrywkowego nakrywającego wierzch naczynia z roztworem
- Sedymentacja jest najrzadziej stosowaną metodą badania kału, ma największe znaczenie w przypadku jaj przywr. Często wykorzystywana jest do badań kału dużych ssaków roślinożernych, w medycynie zwierząt egzotycznych ma znaczenie marginalne. W tym przypadku jaja pasożytów mają opaść na dno roztworu i stwierdzane są później w zebranym osadzie.
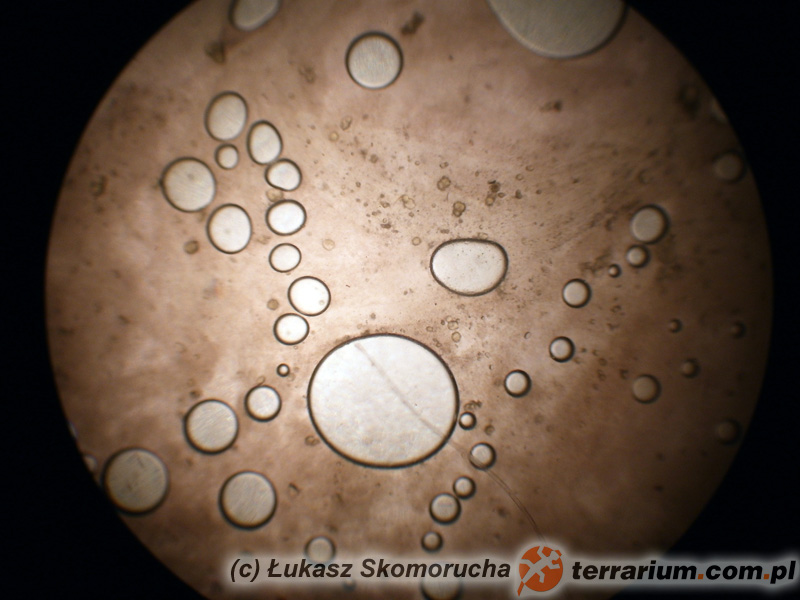
Po odpowiednim przygotowaniu preparatu i włożeniu go na stolik mikroskopu przystępuje się do oceny i interpretacji badanej próbki. Tu istotne jest obeznanie lekarza z wyglądem pasożytów, fragmentów ich ciał, form rozwojowych oraz całej masy artefaktów. Każda grupa pasożytów charakteryzuje się swoista budową, wielkością i kształtem. Zupełnie inaczej wyglądają jaja owsików i glist w typie Ascaridia, mimo że oba te pasożyty są nicieniami. Jaja tasiemców są zdecydowanie mniejsze od jaj większości nicieni. W przypadkach, kiedy istotne jest dokładniejsze oznaczenie gatunku pasożyta (przy podejrzeniu np. baylisaskariozy u szopów praczy i rozróżnieniu jej od mniej niebezpiecznych pasożytów, jak np. Toxocara spp.; (patrz Baylisascaris procyonis jako potencjalne niebezpieczeństwo dla człowieka ze strony domowych szopów) bardzo istotna jest strukturalna budowa jaj. Ustalenie gatunku lub chociaż rodziny pasożytów jest istotne w dalszym postepowaniu. Nie ma bowiem leku, który zabija wszystkie rodzaje pasożytów. Leki przeciw nicieniom w większości przypadków nie podziałają w przypadku inwazji tasiemców i na odwrót. Żaden ze standardowo stosowanych leków nie jest w stanie spowodować uwolnienia zwierzęcia od kokcydiów. Dlatego coś takiego jak „odrobaczanie profilaktyczne” albo „w ciemno” nie powinno być w ogóle stosowane. To tak, jakby przy chorobie wątroby podawać lek nasercowy. Dokładne poznanie istoty problemu jest podstawą sukcesu terapii !!
Artefakty to różnego typu zjawiska/przedmioty/organizmy, które w badanej próbce znalazły się przypadkowo, nie mają znaczenia diagnostycznego (to znaczy nie są przyczyną choroby), ale poprzez swoją obecność mogą utrudniać interpretację badanej próbki. Oto kilka przykładów najczęściej zdarzających się artefaktów:
- Tkanki roślinne – mogą przybierać najróżniejsze kształty: niestrawione do końca włókna mogą przypominać na pierwszy rzut oka segmentowane ciało pasożyta, pyłki roślinne o różnorodnych kształtach mogą sugerować obecność jaj pasożytów, wreszcie niektóre barwniki zawarte w skarmianych roślinach mogą barwić w nietypowy sposób odchody
- Jaja owadów karmowych – szczególnie często świerszczy; są bardzo duże jak na obiekty mikroskopowe, widać je gołym okiem, czasami stanowią większą część preparatu
- Pasożyty zwierząt karmowych – czasami w próbkach kału węży lub większych mięsożernych jaszczurek można znaleźć jaja pasożytniczych nicieni, które obecne były w przewodzie pokarmowym skarmianych zwierząt, np. nicienie mysie, które dla węży są całkowicie neiszkodliwe
- „Pseudopasożyty” – organizmy, które w próbce kału znalazły się przypadkowo, nie prowadzą pasożytniczego trybu życia. Za przykład mogą posłużyć tu nicienie wolno żyjące w glebie czy roztocza szukające na kale pożywienia.
Niezwykle istotna kwestią jest to, by dostarczony na badanie kał był możliwie jak najświeższy, to znaczy aby od momentu wydalenia do momentu badania upłynęło jak najmniej czasu. Badanie kału starszego niż 24 godziny uznaje się już za mało wiarygodne. Najpewniejsze są badania kału w maksymalnie 12 godzin od wydalenia. Jeśli czas do badania wynosić ma między 12 a 24 godziny, próbkę kału najlepiej jest umieścić w szczelnym pojemniczku i włożyć go na ten czas do lodówki. Można również uzyskać próbkę kału poprzez dokonanie już w samym gabinecie weterynaryjnym delikatnej lewatywy połączonej z masażem powłok brzusznych i stymulacją śluzówki kloaki. W ostateczności, u osobników, które już od dłuższego czasu nie przyjmują pokarmu, badanie parazytologiczne można przeprowadzić poprzez pobranie wymazu z kloaki, zaznaczyć jednak należy, iż ta metoda jest stosunkowo mało wiarygodna.
Niestety, nawet w trakcie inwazji nie każda defekacja (wydalenie kału) wiąże się z jednoczesnym wydaleniem do środowiska jaj/cyst/larw pasożytów. Przebadanie takiej próbki daje wynik negatywny (brak pasożytów) pomimo ich faktycznej obecności. Mówimy wówczas o próbie fałszywie negatywnej. Dlatego najbardziej wiarygodne wyniki daje przebadanie kilku próbek kału z różnych, niezbyt od siebie oddalonych pobrań. Przyjmuje się, iż trzy badania z wynikiem negatywnym (bez stwierdzenia obecności pasożytów) wykonane w odstępach mniej więcej 24-godzinnych dają 100% pewność braku inwazji pasożytów. W praktyce zwykle wykonuje się jedno, maksymalnie dwa badania kału.
Jak zatem widać, badanie parazytologiczne kału nie jest czynnością nader trudną, wymaga jednak od lekarza weterynarii dosyć wszechstronnej wiedzy. Wynik najprostszych badań parazytologicznych można uzyskać niemal od ręki, dosłownie w przeciągu 5 minut. Zwrócić należy także uwagę, iż badanie to nie należy do kosztownych, za to jego wartość względem zdrowotności zwierzęcia jest nieoceniona. Dotyczy to zarówno zwierząt utrzymywanych pojedynczo, jak również większych grup zwierząt, prowadzonych przez hodowców, którzy regularnie powinni współpracować z lekarzem weterynarii w celu szybkiego wykrycia i zapobiegnięcia rozprzestrzenieniu się choroby na resztę hodowli, a przez to podniesienie jej zdrowotności i wyników hodowlanych.
Opracowanie i źródła informacji
Opracował lek.wet. Łukasz Skomorucha
FUNDACJA EGZOTYKA
na podstawie własnych doświadczeń oraz literatury:
Mader D.R. ‘Reptile medicine and Surgery’
Gundłach J.L., Sadzikowski A.B. „Parazytologia i parazytozy zwierząt”
lukasz_skomorucha@wp.pl
Przychodnia Weterynaryjna SALVET
ul.Ratuszowa 1/3
Warszawa
22 670 20 42
Przychodnia Weterynaryjna OSTOJA SALVET
ul. Hlonda 2 lok.7
22 651 89 79
www.salvet.pl / http://www.facebook.com/pages/Przychodnia-Weterynaryjna-Salvet/161699140514265
Liczba wyświetleń: 20578






















 [14]
[14]