Endopasożytnicze choroby gadów
Artykuł zawiera wyłącznie materiały poglądowe. Podjęcie wszelkich prób terapii powinno w pierwszej mierze zostać poparte dokładną diagnostyką laboratoryjną oraz konsultacjami ze specjalizującym się w leczeniu gadów lekarzem weterynarii.
Gady, zarówno te zamieszkujące środowisko naturalne, jak i te żyjące w hodowlach na całym świecie, bardzo często zarażone są różnymi pasożytami wewnętrznymi. Wiele gatunków pasożytów nie stanowi poważnego zagrożenia dla swoich gospodarzy. Jednak w obliczu stresu związanego z transportem, niewłaściwą hodowlą, nadmierną liczbą osobników w terrarium, złymi warunkami higienicznymi, z pozoru niegroźna inwazja pasożytnicza może przerodzić się w poważną chorobę prowadzącą w ostateczności nawet do śmierci.
Do gromady gadów (Reptilia), obejmującej ponad 6 000 gatunków, zalicza się węże, jaszczurki, hatterie, żółwie i krokodyle. Wszyscy przedstawiciele gromady gadów toczą odwieczną walkę z pasożytującymi organizmami jedno, jak i wielokomórkowymi. W środowisku naturalnym, uwzględniając oczywiście pierwotniaki jelitowe, niemal 100% populacji wolno żyjących gadów zarażonych jest pasożytami. Jednak obecność pasożytów nie zawsze musi łączyć się z wystąpieniem stanu chorobowego.
U gadów, tak jak w przypadku innych zwierząt, podatność na choroby wywołane inwazjami pasożytniczymi warunkowana jest przez stres (np. w hodowli), czynniki środowiskowo – klimatyczno – higieniczne (temperatura, wilgotność, czystość), inną, jednocześnie trwającą chorobę (np. infekcje bakteryjne, wirusowe), intensywność inwazji i liczbę pasożytów, obecność żywicieli pośrednich, stopień odżywienia żywiciela ostatecznego oraz jego wiek. W hodowlach na całym świecie pasożyty mające bezpośredni cykl życiowy zdecydowanie dominują nad tymi, wymagającymi w swoich cyklach żywicieli pośrednich. W następstwie parazytyzmu pasożyty konkurują o pokarm z żywicielem, uszkadzają jego tkanki, zaburzają homeostazę płynów ustrojowych, blokują naczynia limfatyczne i krwionośne, powodują obrzęki narządów wewnętrznych, owrzodzenia, martwicę i anemię. Diagnoza chorób pasożytniczych polega przede wszystkim na identyfikacji dorosłych form pasożytów, larw lub jaj, bowiem inwazje tylko nielicznych gatunków parazytów skutkują określonymi, specyficznymi objawami klinicznymi i zmianami patologicznymi. Tym samym, silnie zarażone gady wykazują objawy zupełnie niespecyficzne, to znaczy tracą na wadze, stają się apatyczne i przestają jeść.
Protozoa (pierwotniaki)
-
Typ: Sarcomastigophora
-
Ameby (Amoebozoa, Amoeba)
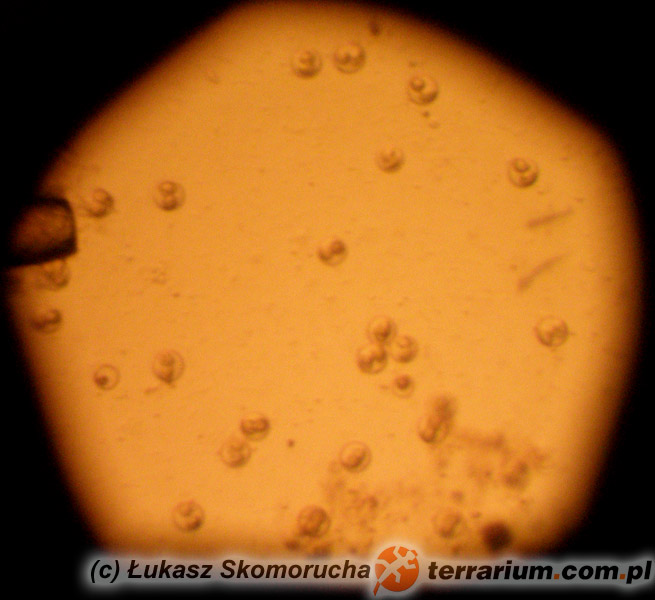
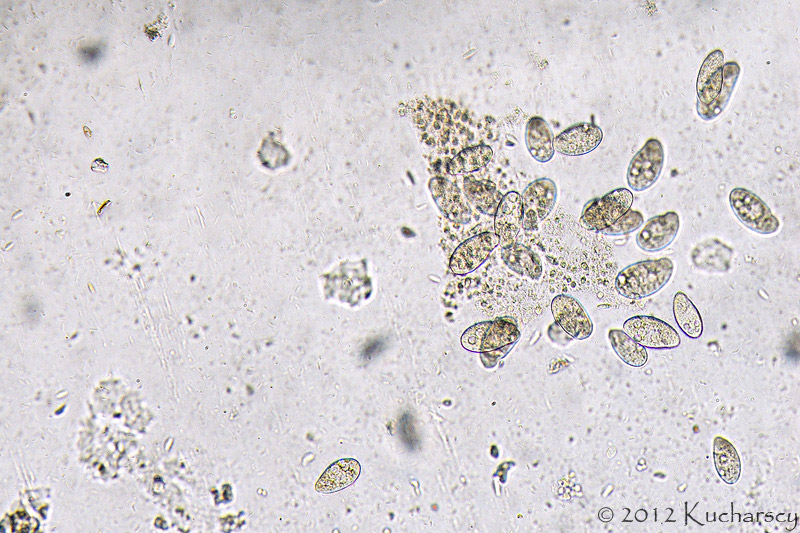
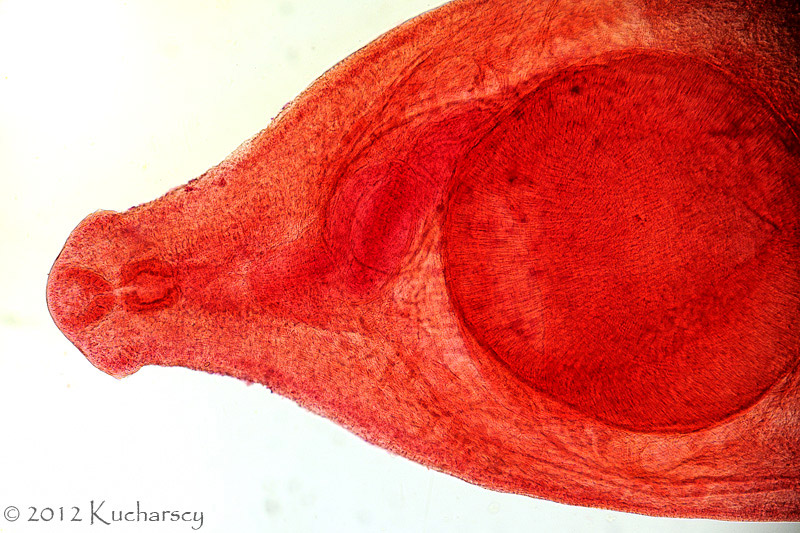
Do tej pory opisano 6 rodzajów ameb występujących u gadów. Gatunki patogenne i te o potencjalnych właściwościach chorobotwórczych, zalicza się do trzech z nich. Acanthamoeba i Naegleria zidentyfikowano u węży z zapaleniem opon mózgowych i mózgu. Infekcje wywołane różnymi gatunkami Entamoeba notowano we wszystkich grupach gadów, przy czym najczęstszym czynnikiem etiologicznym okazywała się jednak Entamoeba invadens. Obecność tego pierwotniaka wiąże się z natychmiastowym wybuchem epizootii (czyli epidemii choroby zakaźnej – pasożytniczej u zwierząt, o zdecydowanie zwiększonym nasileniu, występującej na danym terenie) lub enzootii (czyli długotrwale występującej choroby zakaźnej – pasożytniczej zwierząt, obejmującej dany teren, ze stałym nasileniem) z wysokim wskaźnikiem śmiertelności u węży i w mniejszym stopniu u jaszczurek. Roślinożerne żółwie lądowe i rozmaite, preferujące środowisko wodne gatunki gadów (spośród których najwyższą wrażliwość stwierdzono u dużych gatunków żółwi lądowych z niegdyś licznego rodzaju Geochelone i waranów – Varanus) również mogą wykazywać objawy kliniczne amebozy. W przypadku większości zarażeń, pozostają jednak bezobjawowymi nosicielami E. invadens. Wirulencja tego gatunku pierwotniaka wydaje się zmieniać w zależności od położenia geograficznego, wywołując tym samym zdecydowanie poważniejsze w skutkach choroby wśród gatunków gadów, których naturalny zasięg występowania nie pokrywa się z pierwotnym rozmieszczeniem geograficznym pasożyta.Wydalone wraz z kałem cysty E. invadens muszą zostać połknięte przez gada. Wtedy też w przewodzie pokarmowym rozwijają się w inwazyjne trofozoity. W amebozie węży pasożyty, poprzez układ wrotny wątroby i żyłę wrotną, trafiają najczęściej właśnie do wątroby, powodując zapalenie jelit i wątroby (enterohepatitis). U żółwi żabuti (Chelonoidis carbonaria) trofozoity rozprzestrzeniają się od dwunastnicy, poprzez przewód żółciowy wspólny, do wątroby, będąc przyczyną martwiczego zapalenia wątroby. Gady cierpiące na amebozę mogą stać się apatyczne, przestać jeść i wydalać śluzowo – krwisty kał. Poza tym u niektórych węży bardzo często uwidacznia się makroskopowo masa/guzy w postaci gromadzącej się w okrężnicy fibryno – martwiczej pseudomembrany. Zarażone gady mogą również sprawiać wrażenie klinicznie zdrowych aż do 24 godzin przed śmiercią lub też ich kondycja ulega znacznemu pogorszeniu się przez okres trwający kilka tygodni.Pośmiertna diagnostyka pełzakowicy polega przede wszystkim na wykryciu cyst i trofozoitów w materiale sekcyjnym oraz pod mikroskopem w preparacie mokrym z zeskrobin ściany jelita. Diagnostyka przedśmiertna opiera się w szczególności na badaniach koproskopowych metodą sedymentacji. Z zsedymentowanej próbki kału przygotowuje się preparat mokry, w którym można pod mikroskopem zaobserwować ruch pseudopodiów ameb. Najdokładniejszej identyfikacji dokonuje się jednak po wcześniejszej, kilkudniowej inkubacji cyst w dwuchromianie potasu. Sporulujące cysty mierzą wtedy od 12 do 20 μm i zawierają od 1 do 4 jąder. Należy w tym miejscu zaznaczyć, że na naturalną florę jelitową gadów składa się między innymi kilka gatunków komensalnych ameb, dlatego też istotne jest właściwe i ostrożne postępowanie diagnostyczne.Gady chore na pełzakowicę powinny zostać natychmiast odizolowane, a ich terraria zdezynfekowane. Zaleca się ścisłą izolację poszczególnych grup gadów ze względu na ich zróżnicowaną odporność na określone gatunki chorobotwórczych ameb. Leczenie złożone zarażonych zwierząt polega na odpowiednim dawkowaniu i podawaniu metronidazolu, właściwym dawkowaniu i podawaniu antybiotyków (na wypadek wystąpienia chorób drugorzędowych będących następstwem zarażenia) oraz na odpowiedniej opiece w trakcie leczenia (właściwe warunki higieniczne/kwarantannowe, pokarm, temperatura, wilgotność). Terapia nie gwarantuje 100% skuteczności. Z tego też względu wszystkie działania powinny koncentrować się na profilaktyce. Co więcej, cysty mogą przetrwać w środowisku bardzo długi czas. Terraria dezynfekuje się za pomocą gorącej pary wodnej i 3% roztworu podchlorynu sodu. Dopiero wtedy możliwe jest ponowne wprowadzenie mieszkańców do zbiornika. Dotychczas nie stwierdzono żadnego przypadku chorobotwórczego wpływu E. invadens na ludzi.
-
Wiciowce
Nieliczne wiciowce zamieszkują światło przewodu pokarmowego większości zdrowych klinicznie gadów. Z tego względu, powiązanie choroby z obecnymi w próbkach kału wiciowcami okazuje się bardzo często niejednoznaczne. Czynniki predysponujące, takie jak niewłaściwa temperatura, wilgotność, stres związany ze zbyt dużą liczbą osobników w terrarium, obecność konkurencji (np. konkurującego samca), przebyte wcześniej choroby, przyczyniają się do nadmiernego rozmnażania się pasożytów w przewodzie pokarmowym żywiciela. Do najpowszechniejszych czynników etiologicznych, szczególnie u węży i jaszczurek, zalicza się gatunki z rodzajów Leptomonas, Hexamastix, Hypotrichomonas, Tetratrichomonas i Tritrichomonas. Gatunki z rodzaju Spironucleus, czasami klasyfikowane jako rodzaj Hexamita, powodują z kolei utratę wagi, postępującą apatię i w ostateczności śmierć u żółwi lądowych. W następstwie inwazji pasożytniczej powiększeniu ulegają nerki. Zmienia się także ich kolor (bledną). W momencie wystąpienia naprawdę silnej inwazji, pierwotniaki kolonizują przede wszystkim nerki, poza tym wątrobę i drogi żółciowe. Gatunki z rodzaju Monocercomas kojarzy się z takimi chorobami jak zapalenie pęcherza żółciowego zdiagnozowane u pytona diamentowego (Morelia spilota spilota) oraz z różnymi innymi chorobami węży, w tym z nieżytem żołądka, zapaleniem jajowodu, biegunką i zapaleniem płuc. Inwazji Giardia przypisuje się z kolei zapalenie jelit. Zwykle jednak gatunki należące do rodzaju Giardia uważa się za niepatogenne dla gadów. Spośród innych wiciowców, u gadów dość powszechnie notuje się gatunki z rodzajów Trypanosoma i Sauroleishmania. Występują one w układzie krążenia.Wiciowce można bardzo łatwo wykryć zarówno w preparacie bezpośrednim, mokrym, jak i w rozmazie wykonanym metodą Wrighta – Giemsy. Próbki kału poddaje się metodzie sedymentacji, jak i wykonuje z nich rozmazy bezpośrednie. Rozmazy przygotowuje się także z popłuczyn płuc, okrężnicy i jajowodu. W leczeniu zaleca się użycie metronidazolu. Nie wolno zapominać również o właściwej opiece, czyli karmieniu (niejednokrotnie siłowemu), suplementacji mineralno – witaminowej oraz podawaniu płynów. Chore zwierzęta należy odizolować, a terrarium poddać dezynfekcji 3% roztworem podchlorynu sodu.
-
-
Typ: Apicomplexa
Podklasa: CoccidiasinaSpośród przedstawicieli podklasy Coccidiasina, u gadów notuje się gatunki z rodzajów: Haemogregarina, Hepatozoon, Cryptosporidium, Eimeria, Sarcocystis i Plasmodium.
-
Cryptosporidium
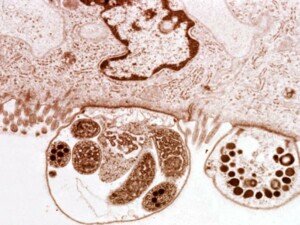
Kryptosporidiozę diagnozowano z dużą częstością u węży i jaszczurek. Wzrasta jej rola jako choroby o znaczeniu ekonomicznym. Stanowi bowiem wielkie niebezpieczeństwo dla wszystkich hodowli na całym świecie. Rodzaj zalicza się do podrzędu Eimeriorina. Dotychczas dokładnie opisano jeden gatunek – Cryptosporidium serpentis. Drugi gatunek, mogący również infekować gady, nie otrzymał jeszcze nazwy naukowej. Droga zarażenia tymi pierwotniakami przebiega w dwojaki sposób: albo przez spożycie wydalonych wraz z kałem, sporulujących oocyst, albo poprzez upolowanie zarażonej pasożytami ofiary (węża lub jaszczurki). W przypadku niektórych infekcji, początkowo podejrzewano służące za pokarm myszy. Wiadomo jednak, że pomiędzy C. serpentis, a C. parvum (czyli gatunkiem najpowszechniej spośród rodzaju zarażającym ssaki) istnieją znaczne różnice w morfologii. Wszelkie eksperymentalne próby zainfekowania myszy „gadzim” gatunkiem Cryptosporidium nie powiodły się. Zdarza się również, że zarażone węże i jaszczurki stają się bezobjawowymi nosicielami.Choroba atakuje zazwyczaj dorosłe węże, choć notowano przypadki zainfekowania młodych osobników. Na wczesnym etapie przebiega najczęściej bardzo gwałtownie. Po spożyciu sporulujących oocyst, wegetatywne stadium rozwija się w błonie śluzowej żołądka, powodując hipertroficzny nieżyt żołądka, powiększenie się jego średnicy i zwężenie jego światła. Typowe objawy kliniczne kryptosporidiozy u węży to utrata wagi, zwracanie pokarmu i twarda opuchlizna środkowej części ciała o długości 5 – 8 cm. Ponadto w diagnostyce choroby (w wykrywaniu charakterystycznych oocyst) wykorzystuje się następujące metody: preparat bezpośredni z kału, badania koproskopowe z użyciem metody flotacyjnej, ultradźwięki, radiografię, badania popłuczyn żołądka, laparotomię, endoskopię i biopsję. Dotychczas nie wynaleziono skutecznej metody leczenia. W związku z wysoce zaraźliwą naturą choroby, brakiem skutecznego leczenia i jej zoonotycznym charakterem, bardzo często zaleca się po prostu eutanazję chorego zwierzęcia. W dezynfekcji pomieszczenia stosuje się 5% roztwór amoniaku oraz 10% roztwór formaliny.
-
Eimeria sp. i Isospora sp.
Eimeria sp. pasożytuje w woreczku żółciowym, drogach żółciowych i nabłonku jelita węży, jaszczurek oraz krokodyli, podczas gdy Isospora sp. występuje tylko w jelitach. Infekcje Eimeria powodują apatię, anoreksję, spadek wagi, wymioty i infekcje jelit. Zarażenie Isospora przebiega zazwyczaj bezobjawowo. Diagnoza kokcydiozy polega na identyfikacji w próbkach kału pierwotniaczych oocyst lub przeprowadzeniu badań histopatologicznych.Inne organizmy podrzędu Eimeriorina również mogą infekować gady. Caryospora sp. zaraża przede wszystkim węże, lecz okazjonalnie także jaszczurki oraz żółwie. Pasożyt ten wywołuje stan nerwowości, anoreksję, spadek wagi. Sarcocystis sp. opisano u węży, jaszczurek i żółwi. Cechuje go złożony cykl życiowy z żywicielem pośrednim. W tym przypadku żywicielami ostatecznymi są ssaki i gady, w szczególności węże. Infekcja Sarcocystis ma charakter samo ograniczający się i przebiega najczęściej bezobjawowo. Tachyzoity i cysty Toxoplasma sp. zidentyfikowano w materiale tkankowym żółwi wodnych, jaszczurek i węży. Dotychczas jednak nie udało się przyżyciowo zdiagnozować objawów toksoplazmozy u gadów. Obecność pierwotniaków w ciele żywiciela, potwierdzona następnie w materiale sekcyjnym, nie wiązała się bowiem z wystąpieniem jakichkolwiek symptomów chorobowych.
-
Hemogregaryny
Kokcydia te charakteryzuje złożony cykl życiowy. Są one powszechnym czynnikiem etiologicznym pasożytniczych chorób gadów. Do transmisji dochodzi poprzez ugryzienie/ukłucie lub połknięcie żywiciela pośredniego, w tym przypadku stawonoga lub pijawki. Bananokształtne, intraerytrocytarne gamonty (czyli osobniki troficzne – odżywiające się) Haemogregarina sp., Hepatozoon sp. i Karyolysus sp. wykrywa się mikroskopowo w barwionych rozmazach krwi. Ciężkim infekcjom towarzyszą anemia i wyniszczenie organizmu.
-
Haemosporina
Podrząd Haemosporina, jako ogólnie pojęty czynnik etiologiczny gadziej malarii, charakteryzuje się złożonym cyklem życiowym. Infekcje Fallisia sp., Haemoproteus sp., Garnia sp. i Saurocytozoon sp., poza okazjonalnie występującą anemią, przebiegają najczęściej bezobjawowo. Rodzaj Plasmodium stwierdzano najczęściej u jaszczurek, sporadycznie u węży, natomiast nigdy u żółwi i krokodyli. Dotychczas opisano 76 gatunków pasożytujących na jaszczurkach. Zarażone, wolno żyjące populacje gadów spotyka się na wszystkich, ciepłych kontynentach świata z wyjątkiem Europy, gdzie nie przeprowadzono jeszcze odpowiednich badań. Plasmodium identyfikowano u wielu gatunków jaszczurek, w tym u legwanów, kameleonów, anolisów. Pierwotniaki te są szczególnie szeroko rozpowszechnione u Sceloporus occidentalis – jaszczurki powszechnie występującej w Kalifornii. Malaria jaszczurek wydaje się przebiegać tylko u żywicieli specyficznych. Do transmisji pasożytów dochodzi poprzez ugryzienie/wkłucie się stawonoga będącego wektorem choroby. Większość zarodźców atakuje wyłącznie erytrocyty. Wyjątek stanowi spotykany u anolisów P. azurophilum, infekujący zarówno leukocyty, jak i erytrocyty. Sporogonia zarodźców zachodzi w ciele żywiciela pośredniego, z kolei schizogonia, jak i gametogonia w ciele gada. W krwi wczesnej fazy infekcji dominują liczne, pozbawione hemoglobiny, niedojrzałe erytrocyty, gdyż zainfekowane, dojrzałe krwinki ulegają degradacji. Obniżenie wydajności transportu tlenu skutkuje spadkiem odporności. Dla samców oznacza to również osłabienie zdolności obrony terytorium. Wykazano ponadto zależność pomiędzy silnym przebiegiem infekcji, a obniżeniem wskaźnika reprodukcji u S. occidentalis. Choroba powoduje splenomegalię, a w ostateczności może doprowadzić także do śmierci. Diagnoza polega na mikroskopowym badaniu rozmazu krwi. Haemoproteus występuje w krwi w postaci gametocytów. W przypadku braku w rozmazie intraerytrocytarnych schizontów, rozróżnienie Plasmodium i Haemoproteus okazuje się najczęściej niemożliwe. Chinina i chinakryna wykazały ograniczoną skuteczność w walce z gadzią malarią.
-
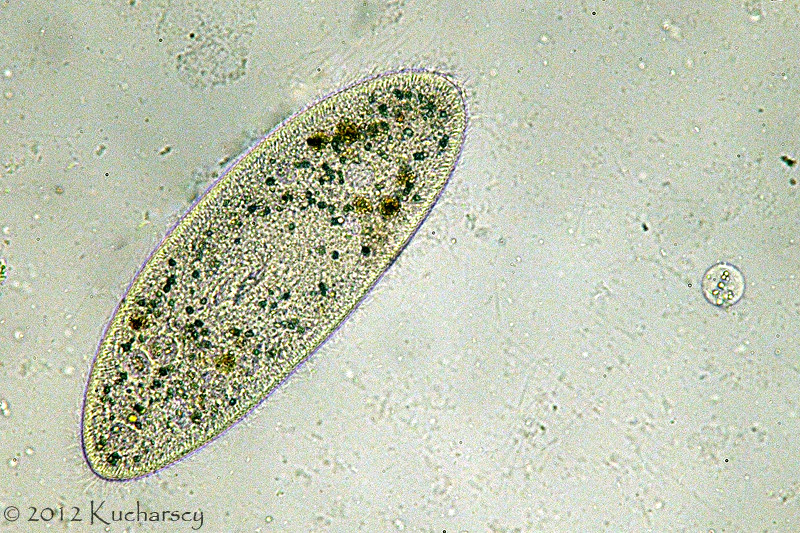
Orzęski (Ciliata)
Orzęski należą do pierwotniaków powszechnie kolonizujących przewód pokarmowy gadów. Jedynym, znanym, patogennym gatunkiem orzęska jest Balantidium coli. Występuje on stosunkowo często u żółwi. Objawy kliniczne balantydiozy przypominają te, towarzyszące groźnym inwazjom wiciowców. Co więcej, B. coli powoduje również ostre zapalenie okrężnicy. Gatunek ten charakteryzuje prosty cykl życiowy. Sporadycznie izoluje się go z próbek kału zdrowych klinicznie żółwi.
Metazoa
-
Płazińce – Platyhelminthes (przywry i tasiemce)
-
Przywry (Trematoda)
Pasożytujący na gadach przedstawiciele gromady Trematoda zaliczają się do dwóch grup: przywr monogenetycznych (o prostym cyklu życiowym), jak i bardziej zróżnicowanych, liczniejszych przywr digenetycznych (o złożonym cyklu życiowym z żywicielem pośrednim – płazem lub bezkręgowcem). Przywry monogenetyczne okazjonalnie zasiedlają pęcherz moczowy, przełyk i górne drogi oddechowe żółwi słodkowodnych. Osiągają niewielkie rozmiary (poniżej 3 mm długości). Zarażone zwierzęta nie wykazują jakichkolwiek objawów chorobowych.Przywry digenetyczne (np. z rodzaju Ochetosoma) bardzo często spotyka się w jamie ustnej węży. Dorosłe osobniki migrują z niej i przez głośnię trafiają do płuc. Kolonizacja płuc przez przywry może wywoływać miejscowe zmiany patologiczne i sprzyjać jednoczesnemu rozwinięciu się bakteryjnego zapalenia płuc. Zazwyczaj jednak, pomimo stwierdzonej patogenności, infekcje przebiegają bezobjawowo. Diagnoza opiera się na identyfikacji dorosłych form pasożyta w przewodzie pokarmowym, jamie ustnej i układzie oddechowym. Jaja wykrywa się w preparatach mikroskopowych wykonanych z popłuczyn płuc lub preparatach z próbek kału przygotowanych metodą sedymentacji. Dotychczas nie opracowano bezpiecznych i skutecznych leków. Dorosłe przywry usuwa się ręcznie. W przypadku tych pasożytów, najważniejszą rolę powinna odgrywać profilaktyka polegająca na eliminacji żywicieli pośrednich.Niektóre gatunki przywr pasożytują w wątrobie, woreczku żółciowym, przewodzie pokarmowym, układzie krążenia i moczowo – płciowym. Ostre infekcje mogą powodować apatię, anoreksję (tym samym spadek wagi), duszności, mocznicę pozanerkową i w ostateczności śmierć. Gatunki z rodzaju Styphylodora zamieszkujące przewód moczowy węży wywołują chroniczne, śródmiąższowe zapalenie nerek. Dorosłe postaci przywr należących do rodzajów Spirorchis i Learedius znajduje się często w układzie krążenia żółwi wodnych i innych, mało odpornych gadów. Patogenność tych przywr wynika z uwolnienia jaj do kompartmentu naczyniowego, co prowadzi do niedrożności naczyń i zapalenia ziarniniakowego przewodu pokarmowego (i innych narządów wewnętrznych), obrzęków kończyn oraz owrzodzenia plastronu i karapaksu. Również i w tym wypadku najważniejszą rolę powinna odgrywać profilaktyka polegająca na eliminacji żywicieli pośrednich, czyli ślimaków.
-
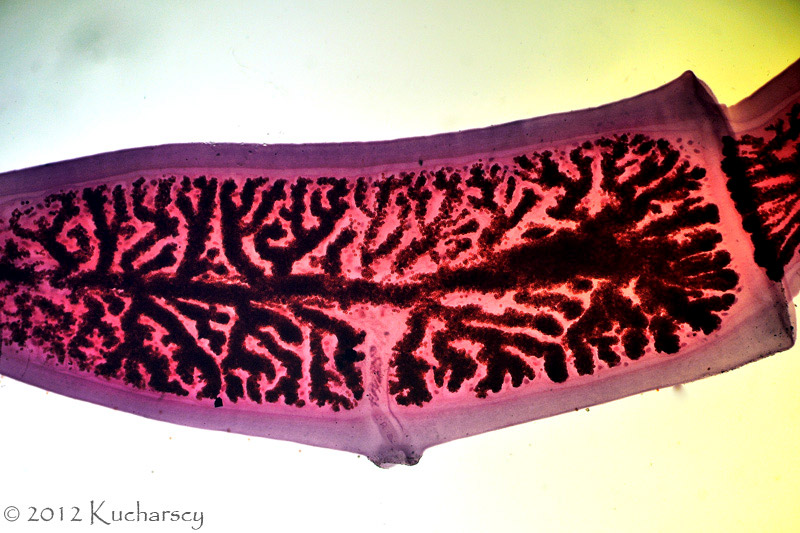
Tasiemce (Cestoda)
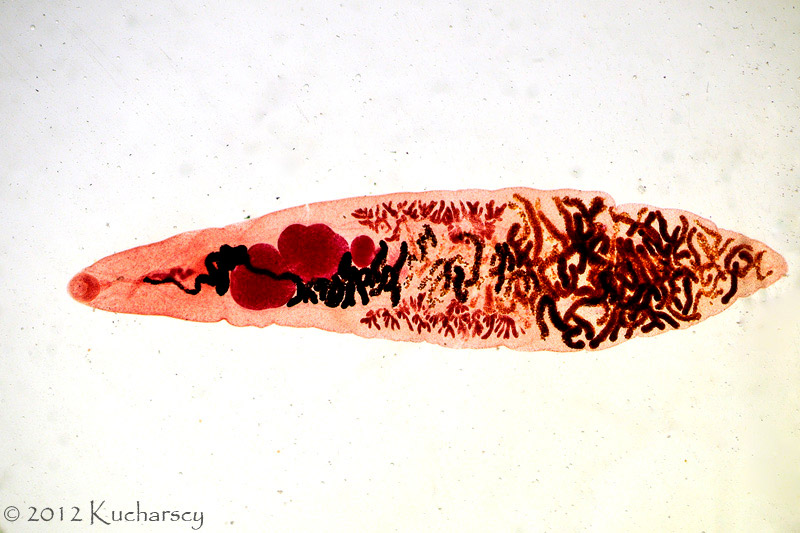
Liczne gatunki tasiemców pasożytujących w jelicie cienkim, stwierdza się najczęściej u węży i jaszczurek. Mogą one pełnić rolę zarówno żywicieli pośrednich, jak i żywicieli ostatecznych. Większość gatunków zarażających gady należy do rzędu Proteocephalidea. Jaja tych niewielkich tasiemców trafiają do środowiska wraz z kałem żywiciela. Nie są jednak wydalane w postaci wypełnionych nimi, dojrzałych proglotydów (członów tasiemca). Silne inwazje prowadzą do anoreksji, ogólnego wyniszczenia, niedrożności jelit i w konsekwencji śmierci.Do tasiemców zarażających gady zalicza się także 12 gatunków należących do rodziny Diphyllobothriidae z rzędu Pseudophyllidea. Pasożyty te osiągają od 10 do 80 cm długości i do 8 mm szerokości. Jaja trafiają do środowiska wraz z odchodami, a puste proglotydy ulegają strawieniu. Jaja przedstawicieli rodziny Diphyllobothriidae wyposażone są w operculum (wieczko). Cecha ta upodabnia jaja Diphyllobothriidae do jaj przywr i tym samym znacznie utrudnia ich rozróżnienie. Silnie zarażone węże bardzo często zwracają zjedzony pokarm. Ponadto dochodzi u nich do ogólnego osłabienia, wychudzenia i wyniszczenia organizmu. Uszkodzone przez tasiemce tkanki stwarzają doskonałe miejsca dla rozwoju infekcji bakteryjnych. Larwy, nazywane plerocerkoidami, stosunkowo często spotyka się u gadów. Osiągają od kilku do ponad 30 cm długości. Występują przede wszystkim w tkance podskórnej, mięśniach międzyżebrowych, jamie otrzewnej lub błonach surowiczych. Silnie zainfekowane gady cierpią na anoreksję i tym samym tracą na wadze. Występujące w tkance podskórnej larwy wywołują delikatną opuchliznę, stąd ich chirurgiczne usunięcie nie stanowi problemu. Osadzenie się larw w tkance mięśniowej skutkuje rozległym obrzękiem i krwotokiem. Istnieje możliwość zarażenia się tasiemcami z rodziny Diphyllobothriidae poprzez spożycie surowego mięsa węża. Sparganozę oczną notuje się we wschodniej Azji.Trzeci rząd tasiemców, Cyclophyllidea, obejmuje rodzaj Mesocestoides. Gady zarażają się zjadając pierwszego żywiciela pośredniego, najczęściej stawonoga, zawierającego larwę – tetrathyridium. Larwy osadzają się w wątrobie, krezce, trzustce i jelicie. Na skutek silnej inwazji dochodzi do poważnych uszkodzeń mechanicznych wymienionych organów. Żywicielami ostatecznymi tych tasiemców są ssaki, w tym ludzie. Diagnozy dokonuje się zazwyczaj pośmiertnie. Wszelkie próby leczenia i usunięcia larw z ciała żywiciela okazały się dotychczas nieskuteczne.
-
-
-
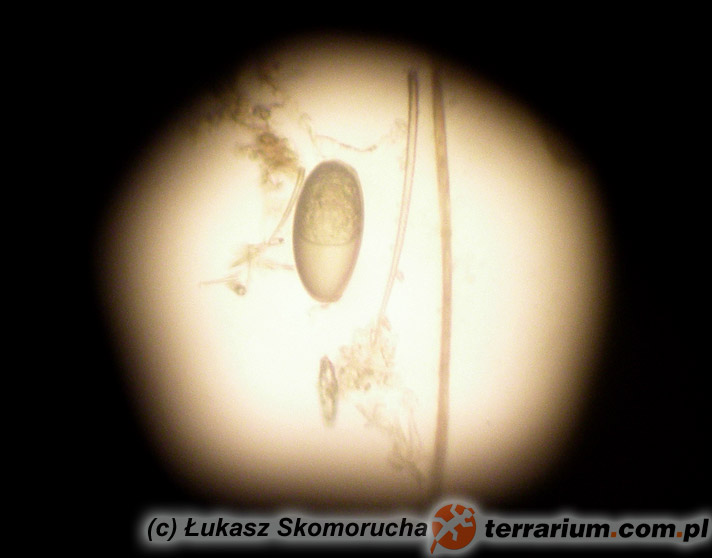
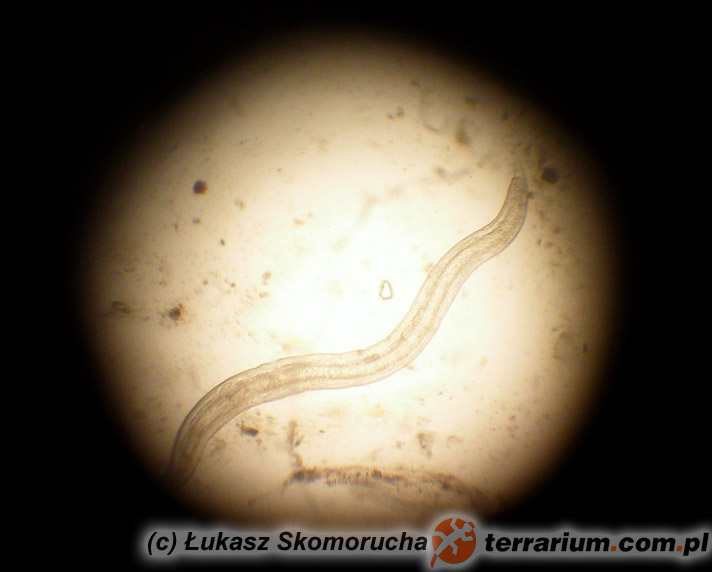
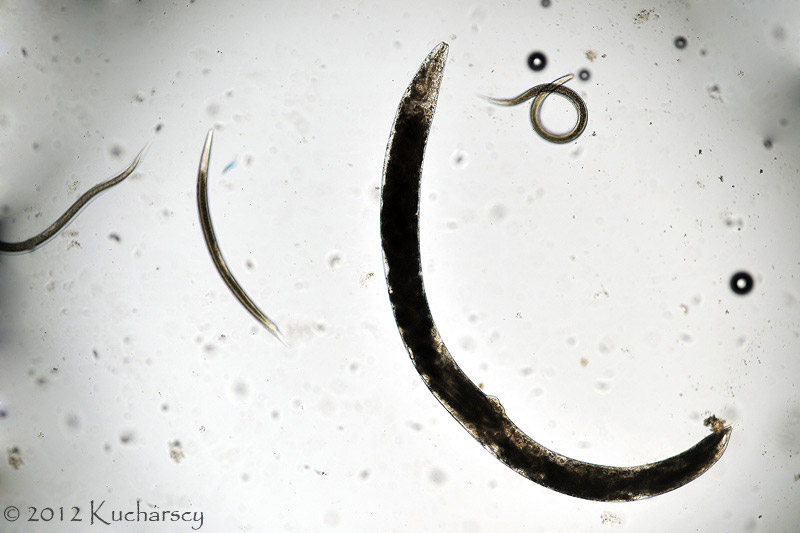
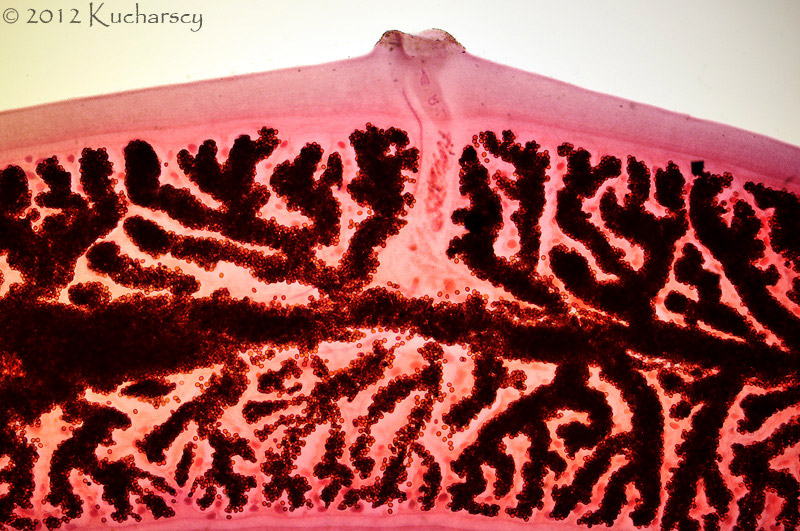
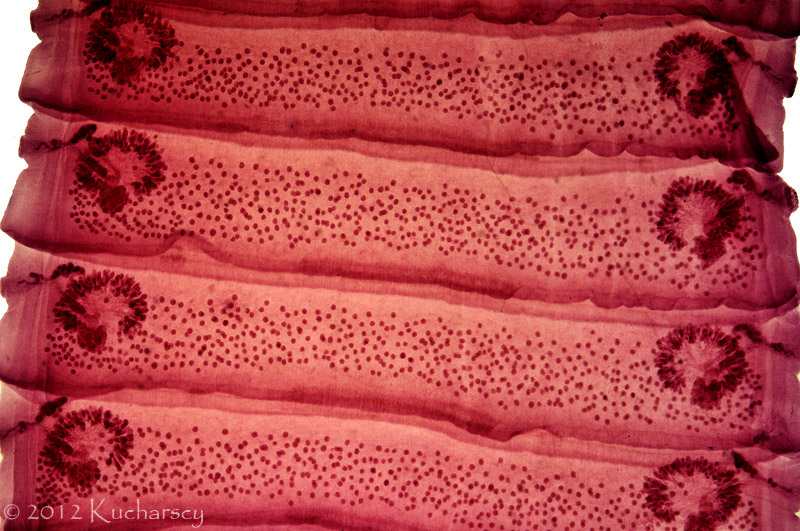
Nicienie (Nematoda)
Nicienie należą do najpowszechniejszych pasożytów wewnętrznych gadów. Objawy kliniczne obserwuje się u zwierząt cierpiących na bardzo silne infekcje i równoczesne choroby/uszkodzenia mechaniczne tkanek będące następstwem tych infekcji. Część nicieni (np. Oxyuridae, Strongyloididae) ma bezpośredni cykl życiowy, inne z kolei (np. większość Ascarididae, Filariidae) pośredni z udziałem żywiciela pośredniego.
-
Ascarididae
Pasożyty te zarażają wszystkie grupy gadów, a w szczególności węże. Żywicielami pośrednimi dla Ophidascaris sp., Polydelphis sp., Hexametra sp. i Amplicaecum sp. są płazy i gryzonie, którymi żywią się węże i jaszczurki. Nicienie powodują obrażenia zarówno jako larwy migrujące przez organy wewnętrzne, jak i osobniki dorosłe osadzone w błonie śluzowej przewodu pokarmowego. Dorosłe robaki znajduje się w przełyku, żołądku oraz jelicie cienkim. U większości nicieni występuje dymorfizm płciowy. Jaja o grubych osłonkach wydalane są do środowiska wraz z kałem żywiciela. Dojrzałe Ophidascaris zasiedlają przełyk i żołądek, gdzie zagnieżdżają się głęboko w błonie podśluzowej, z głową i ogonem wystającymi do światła narządów. Silnie zarażone gady cierpią na anoreksję i obstrukcję jelit. Zwracanie pokarmu nie należy również do rzadkości. Rozległe inwazje przyczyniają się do wzrostu wskaźnika śmiertelności. Zmiany patologiczne obejmują nieżyt żołądka i jelit, martwicę tkanek, owrzodzenia żołądka i błony śluzowej jelit. Często występuje zapalenie ziarniniakowe. Leczenie (zazwyczaj skuteczne), oprócz podawania odpowiednich leków przeciwpasożytniczych, polega przede wszystkim na eliminacji żywicieli pośrednich oraz dokładnym wyczyszczeniu i zdezynfekowaniu terrarium.
-
Strongyloididae
Rodzaj Kalicephalus skupia najwięcej przedstawicieli, spośród całej rodziny Strongyloididae, pasożytujących na gadach. Występują głównie w przewodzie pokarmowym węży. Ich bezpośredni cykl życiowy stanowi bardzo poważny problem we wszystkich hodowlach gadów. Do transmisji dochodzi poprzez spożycie larwy trzeciego stadium. Bardzo możliwe, że również przez skórę. Okres prepatentny (czyli czas od połknięcia jaj do pojawienia się ich w kale) wynosi od 2 do 4 miesięcy. Silna infekcja prowadzi do wrzodów krwotocznych, zapalenia, niedrożności przewodu pokarmowego, anoreksji, osłabienia i w ostateczności śmierci. Leczenie zazwyczaj okazuje się skuteczne. Należy oczywiście pamiętać o przestrzeganiu ścisłej higieny, żeby zapobiec reinfestacji.
-
Spirurida
Przedstawiciele tego rzędu pasożytują na wszystkich grupach gadów. Rząd obejmuje między innymi rodziny Gnathostomatidae i przede wszystkim Filariidae. W tętnicach krezkowych azjatyckich pytonów opisano Macdonaldius oschei (filarię węży Nowego Świata). Powoduje ona obrzęki i poważne, nekrotyzujące zmiany patologiczne skóry. W ciele żywiciela dorosłe robaki osiedlają się zazwyczaj w tylnej części żyły głównej i żyle wrotnej nerki, gdzie przyczyniają się do powstawania tętniaków i zakrzepic. Jednakże większość filarioz ma przebieg subkliniczny. Diagnoza opiera się przede wszystkim na identyfikacji mikrofilarii we krwi lub znalezieniu dorosłych filarii/mikrofilarii bezpośrednio w ranach. Kontrola przebiegu infekcji obejmuje między innymi zwalczanie wektorów filarii (np. kleszczy i komarów).
-
Rhabditida
Do tego rzędu należą między innymi przedstawiciele rodzajów Rhabdias i Entomelas, czyli nicienie płucne węży i jaszczurek, wywołujące poważne schorzenia płuc. Objawy kliniczne obejmują zapalenie jamy ustnej, ciężki oddech, wysięk i akumulację płynu wydzielniczego wokół głośni. Strongyloides sp., inny przedstawiciel rzędu, pasożytuje z kolei w przewodzie pokarmowym i jest sprawcą biegunek, anoreksji, utraty wagi i aktywności u węży. Zarówno Strongyloides, jak i Rhabdias spotyka się w środowisku w fazie wolnej, to znaczy poza ciałem żywiciela. Transmisja przebiega w sposób bezpośredni. Infekcja może wystąpić bez konieczności udziału stadium wolno żyjącego. Postać inwazyjna – larwa, bardzo często aktywnie i bezpośrednio penetruje skórę żywiciela lub zostaje połknięta wraz z zanieczyszczonym pokarmem oraz wodą. Odróżnienie morfologiczne identyfikowanych w kale jaj Strongyloides od jaj Rhabdias wydaje się właściwie niemożliwe. Jedynie płukanie płucne pozwala wykazać obecność tylko embrionujących jaj Rhabdias.
-
Oxyuridae
Owsiki powszechnie notuje się u żółwi i jaszczurek. Rzadko jednak przyczyniają się do wystąpienia stanu patologicznego. Pasożyty te zasiedlają przede wszystkim okrężnicę. Podłużne jaja wydalane są wraz z kałem. Larwy zaczynają się rozwijać w jajach już z chwilą opuszczenia ciała żywiciela wraz z odchodami. Silnie zarażone żółwie zazwyczaj odmawiają przyjmowania pokarmu tuż po zakończeniu hibernacji. Ponadto u jaszczurek mogą wystąpić zaparcia.
-
-
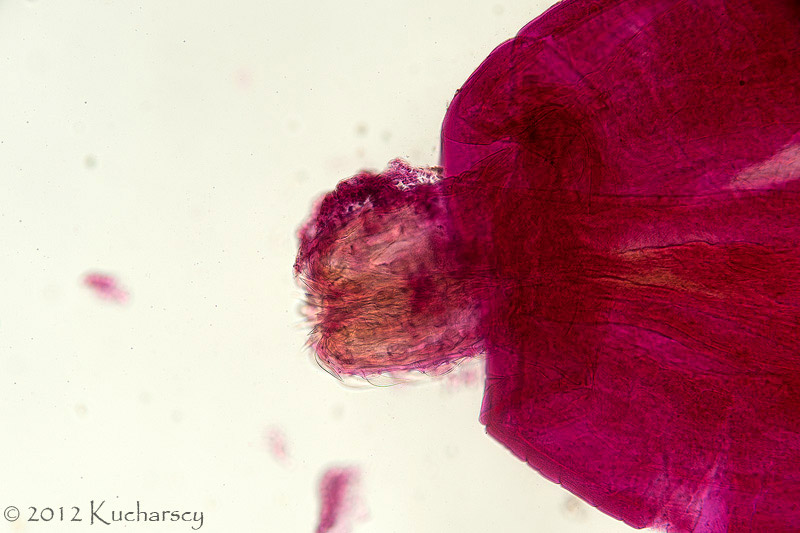
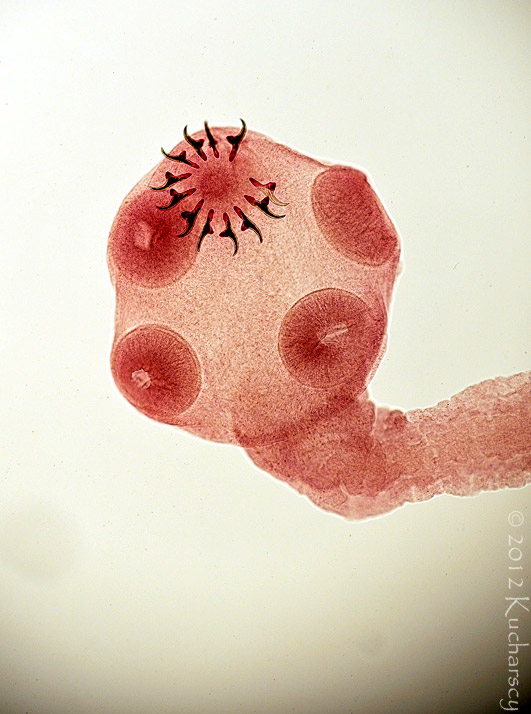
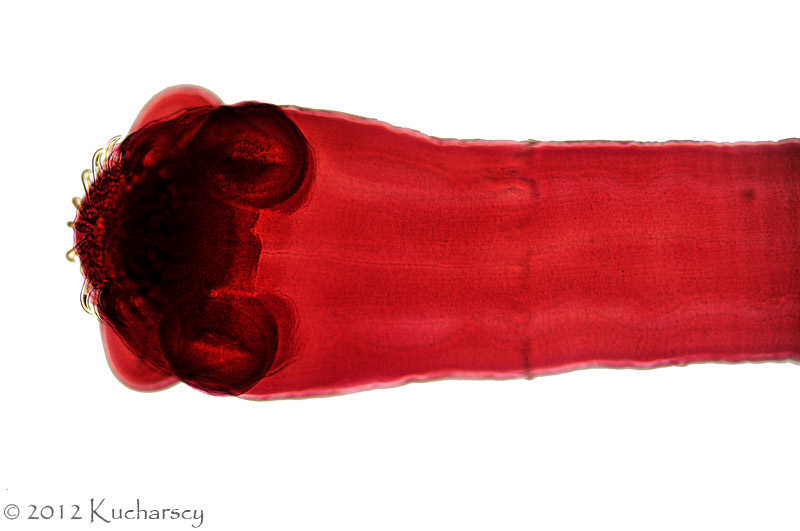
Typ: Acanthocephala
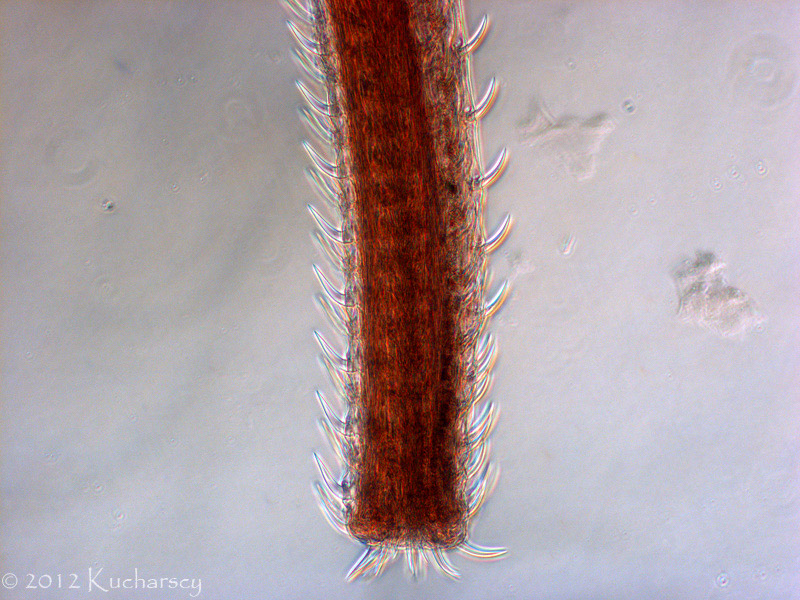
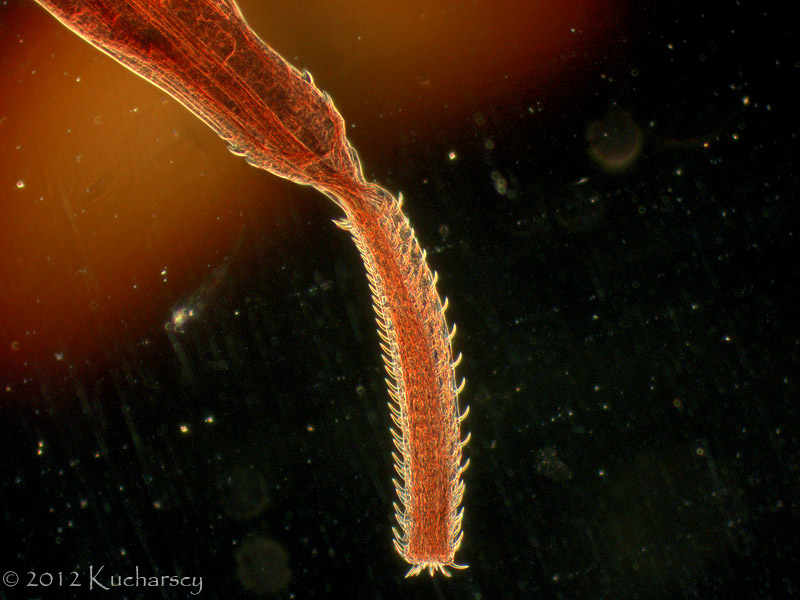
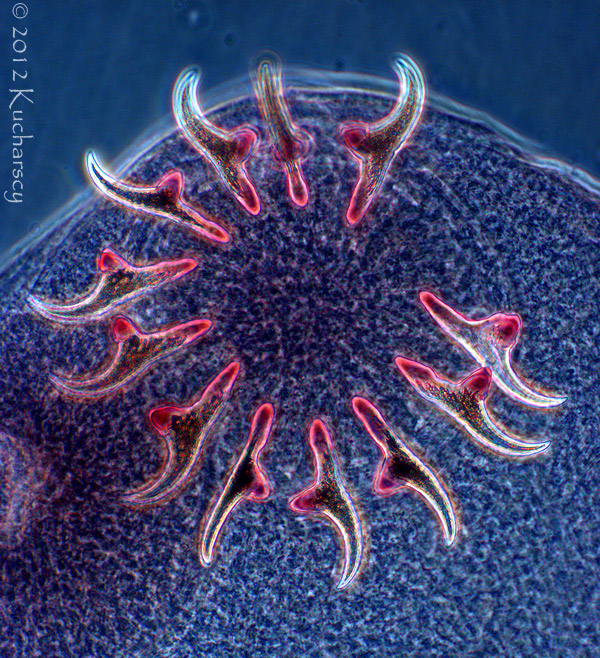
Kolcogłowy charakteryzują się brakiem przewodu pokarmowego i obecnością ryjka opatrzonego wieńcem haczyków i kolców zlokalizowanego na przednim końcu ciała. Dorosłe postaci kolcogłowów spotyka się najczęściej w przewodzie pokarmowym węży i żółwi wodnych. Żywicielami pośrednimi są bezkręgowce, aczkolwiek gady mogą stać się żywicielami paratenicznymi (rezerwowymi). W takim przypadku niedojrzałe formy zasiedlają krezkę i zagnieżdżają się w ścianie przewodu pokarmowego zarażonego gada. Diagnozy dokonuje się poprzez identyfikację w kale owalnych jaj o grubych osłonkach. Kliniczne objawy rzadko łączy się z obecnością form dorosłych lub niedojrzałych tych robaków. Dotychczas nie wynaleziono skutecznych metod leczenia.
-
Podgromada: Wrzęchy (Pentastomida)
Pasożyty należące do podgromady wrzęch przejawiają cechy zarówno stawonogów, jak i pierścienic. Występuje u nich rozwój pleomorficzny. Stadium larwalne przypomina roztocze, natomiast stadia nimfy i dojrzałego osobnika są podobne do przedstawicieli pierścienic. Otwór gębowy dorosłych wrzęch, osadzony na stożkowato rozszerzonym, przednim odcinku ciała, otaczają 4 wyrostki. Każdy z nich wyposażony jest w oskórkowy haczyk. Wyrostki te służą jako narządy czepne. Tułów charakteryzuje się metamerią zewnętrzną, to znaczy każdy gatunek posiada stałą dla siebie liczbę zewnętrznych pierścieni. Stadia młodociane wszystkich gatunków pokrywa dodatkowo gęsta sieć pierścieniowato ułożonych, oskórkowych kolców.Pentastomida to prawie wyłącznie pasożyty gadów. Do rodzajów najczęściej spotykanych u węży należą: Armillifer (pytony i żmije), Kiricephalus (węże właściwe) i Porocephalus (boa i grzechotniki). Dorosłe robaki na ogół pasożytują w układzie oddechowym (szczególnie w płucach). Świeżo wyprodukowane jaja, zawierające pierwotne larwy, dojrzewają w plwocinie. Następnie wydalane są wraz z kałem do środowiska, gdzie rozwijają się w stadium inwazyjne zarażające żywicieli pośrednich (przede wszystkim ssaki, w tym naczelne, również człowieka!). Larwy wwiercają się aktywnie w ścianę jelita żywiciela pośredniego. W dalszej kolejności, wraz z krwią, trafiają do narządów wewnętrznych, w których osiągają dojrzałość.Gady służą także za żywicieli pośrednich. Osobliwością cyklu życiowego pasożytujących na gadach wrzęch jest to, że organizm będący żywicielem pośrednim stoi na wyższym szczeblu drabiny ewolucyjnej, aniżeli organizm będący żywicielem ostatecznym.Większość inwazji, pomimo niejednokrotnie dużej liczby larw i dorosłych robaków oraz ich zdolności do migracji przez tkanki, przebiega bezobjawowo. W niektórych przypadkach może jednak dojść do poważnego w skutkach wyniszczenia organizmu żywiciela (między innymi poprzez bezpośrednie uszkodzenia tkanek lub niedrożność tchawicy). Pasożyty zlokalizowane pod skórą bardzo często przyczyniają się do jej wybrzuszania. Zarażenie człowieka ma charakter zazwyczaj przypadkowy. Inwazje u ludzi notowano dotychczas w Afryce i Azji Południowo – Wschodniej. Większość infekcji u ludzi przebiega jednak w sposób bezobjawowy.Przedśmiertna diagnostyka opiera się przede wszystkim na badaniach koproskopowych oraz wykrywaniu jaj w popłuczynach płuc. Nowo zakupione gady należy poddać kwarantannie. Każdy hodowca powinien mieć na uwadze zoonotyczny charakter wrzęch. Pentastomida, jako czynnik zoonotyczny, mogą wywoływać choroby odzwierzęce u ludzi. W wypadku wykrycia jaj w materiale należy przestrzegać ścisłych zasad higieny. Podawanie gadom wyłącznie laboratoryjnych, „czystych” gryzoni pozwala do minimum ograniczyć możliwość zarażenia się (na przykład węży) wrzęchami. Dotychczas nie opracowano skutecznych metod leczenia. Stosowanie leków przeciwko płazińcom wydaje się nieskuteczne w związku z pozajelitowym środowiskiem życia wrzęch.
-
Pseudopasożyty
Dieta gadów składa się z owoców, warzyw, bezkręgowców, ryb, płazów, innych gadów, ptaków oraz ssaków. Z tego względu odchody gadów bardzo często zawierają różnego rodzaju artefakty w postaci resztek niestrawionych fragmentów roślin, bezkręgowców, czy jaj pasożytów pasożytujących na zwierzętach karmowych (niespecyficznych względem gadów). Problemy we właściwej diagnostyce stwarzają przede wszystkim preparaty przygotowane bezpośrednio z próbki kału, czyli tak zwane preparaty przyżyciowe. Diagnostyka oparta na tego typu preparatach wymaga zatem dużego doświadczenia i wiedzy, by uniknąć, na podstawie błędnej identyfikacji, niepotrzebnego lub też niewłaściwego leczenia.
Opracowanie i źródła informacji
Mikołaj Kaźmierczak
Bibliografia
- Beck W., Pantchev N. 2006. Praktische Parasitologie bei Heimtieren Schlütersche Verlagsgesellschaft mbH & Co. KG, Hannover: 229 – 293.
- Cranfield M.R., Graczyk T., Wright K. 1999. Cryptosporidiosis. Bull. Assoc. Reptilian Amphibian Veterinarians 9:15 – 24.
- Kaneene J.B., Taylor R.F., Sikarskie J.G., Meyer T.J., Richter N.A. 1985. Disease patterns in the Detroit Zoo: a study of reptilian and amphibian populations from 1973 through 1983. Javma 187:1132 – 1133.
- Kenny M.J., Shaw S.E., Hillyard P.D., Forbes A.B. 2004. Ectoparasites and haemoparasite risks associated with imported exotic reptiles. Vet. Rec. 154: 434 – 435.
- Köhler G. 1996. Krankheiten der Reptilien und Amphibien. Ulmer, Stuttgart. 169 str.
- Mcconachie E.W. 1955. Studies of Entamoeba invadens Rodhain, 1934 in vitro, and its relationship to some other species of Entameba. Parasitology 45:452 – 481.
- Moravec F. 2001. Trichinelloid Nematodes Parasitic in Cold Blooded Vertebrates. Academia (Praha). 429 str.
- Schneller P., Pantchev N. 2008. Parasitology in Snake, Lizards and Chelonians. Edition Chimaira, Frankfurt Am Main. 208 str.
- Xiao L., Ryan M., Graczyk T.K., Limor J., Kombert M., Jung E.R. 2004. Genetic diversity of Cryptosporidium spp. in captive reptiles. Apel. Environ. Microbiol. 70:891 – 899.
Liczba wyświetleń: 17223






















 [10]
[10]


















podzielić na strony