„Weterynaria w Praktyce” wydawnictwa Elamed
Kryptosporidioza gadów
Kryptosporidioza jest chorobą wywoływaną przez pierwotniaki z rodzaju Cryptosporidium, cała pełna systematyka przedstawia się następująco (2, 3):
Typ: Apicomplexa Levine, 1970
Gromada: Conoidasida Levine, 1988
Podgromada: Coccidiasina Leuckart, 1879
Rząd: Eucoccidiorida Leger and Duboscq, 1910
Podrząd: Eimeriorina Leger, 1911
Rodzina: Cryptosporidiidae Leger, 1911
Rodzaj: Cryptosporidium Tyzzer, 1907
Po raz pierwszy zostały one opisane w 1907 roku przez Ernesta E. Tizzer’a (2, 4), jednakże jego odkrycie zostało uznane za mało ważne i przez ponad pół wieku nikt się nim nie zainteresował. Dopiero w latach 70 – tych XX wieku zaczęto się interesować Cryptosporidium, gdyż udowodniono, że jest ono przyczyną biegunek u bydła. W 1976 roku po raz pierwszy odkryto tego pierwotniaka u ludzi (2) i od tego momentu badania nabrały tempa (3). W ciągu tych ostatnich 40 lat zostało odkrytych kilkanaście gatunków, które przyporządkowano do rodziny Cryptosporididae, jednakże systematyka tej rodziny jest ciągle kontrowersyjna i wraz z biegiem czasu odkrywane są nowe gatunki a część starych przenoszonych jest do innych rodzin.
Obecnie systematyka oparta jest na podziale pod względem specyfiki gospodarczej i wielkości oocysty i wyróżnia się od 8-14 gatunków (2, 23)
| Nazwa | Żywiciel |
| Cryptosporidium hominis | Ludzie |
| Cryptosporidium parvum | Ssaki (w tym ludzie) |
| Cryptosporidium muris | Gryzonie |
| Cryptosporidium andersoni | Bydło |
| Cryptosporidium felis | Koty |
| Cryptosporidium canis | Psy |
| Cryptosporidium wrairi | Świnka morska |
| Cryptosporidium baileyi | Ptaki |
| Cryptosporidium meleagridis | Ptaki |
| Cryptosporidium galli | Ptaki |
| Cryptosporidium serpentis | Gady |
| Cryptosporidium nasorum | Ryby |
| Cryptosporidium molnari | Ryby |
| Cryptosporidium saurophilum | Gady |
U gadów po raz pierwszy Cryptosporidium zostało opisane w 1977 roku przez Brownstein’a (4), a w 1980 Levine nadał mu nazwę Cryptosporidium serpentis (4). W 1995 Pavlasek et al. opisali nowy gatunek Cryptosporidium varani znaleziony w jelitach warana Varanus prasinus (4). W 1998 Koudela & Modry opisali Cryptosporidium saurophilum (którego oocysty są mniejsze niż u Cryptosporidium serpentis) u scynka Eumeces schneideri(4). Wydaje się, że Cryptosporidium saurophilum i Cryptosporidium varani to ten sam gatunek.
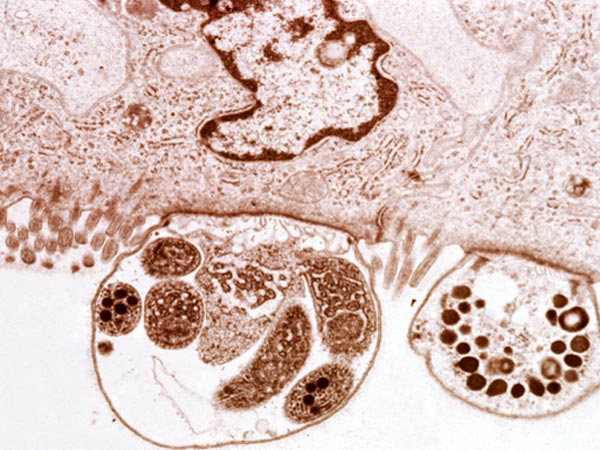
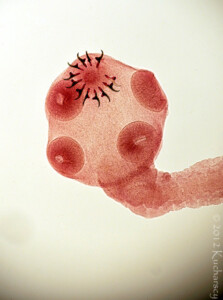
Pierwotniaki z rodzaju Cryptosporidium są niewielkimi (4-8µm) owalnymi pasożytami, bytującymi w przewodzie pokarmowym (szczególnie w żołądku i jelitach). Cykl rozwojowy jest złożony z wielu etapów. Został on dobrze poznany u ssaków, jednakże brak jest danych odnośnie tego jak wygląda u gadów i uznaje się że jest on podobny jak u ssaków. Wyróżnia się w nim etapy rozmnażania bezpłciowego (schizogonia) oraz etapy rozmnażania płciowego (sporogonia) – oba zachodzą na terenie organizmu żywiciela. Natomiast pewna część cyklu rozwojowego (tzn. nabywanie inwazyjności przez oocysty) zachodzi w środowisku zewnętrznym poza organizmem człowieka. W cyklu rozwojowym Cryptosporidium wyróżnia się wiele stadiów rozwojowych (1). Oocysta (wielkości 6,3×5,5µm (6) po dostaniu się do organizmu człowieka uwalnia w żołądku lub jelicie cienkim 4 sporozoity, które atakują komórki nabłonka błony śluzowej, wnikają do nich, a następnie przekształcają się w schizonty. W okresie około 1 tygodnia od zarażenia schizonty rozpoczynają etap rozmnażania bezpłciowego (schizogonię) – wytwarzane są meronty I typu z nich powstają merozoity (z każdego schizonta 6-8 merozoitów), merozoity opuszczają komórkę i mogą tworzyć meronty II typu a z nich merozoity II typu lub przekształcać się w mikro- i makrogametocyty, a następnie odpowiadające im mikro- i makrogamety (2).
Cryptosporidium sp. występują u wszystkich kręgowców, wśród gadów izolowano je od (11):Rozpoczyna się etap rozmnażania płciowego – gamety łączą się, powstaje zygota, która otacza się otoczką tworząc oocystę wewnątrz której powstają 4 sporozoity. Powstają dwa rodzaje oocyst: jedne z grubą podwójną ścianą, są one wydalane z kałem do środowiska oraz drugie z cienką ścianą które od razu ekscystują uwalniając sporozoity i prowadząc do autoinfekcji. Okres prepatentny wynosi 3 dni (7).
- jaszczurek (legwanów, agam, kameleonów, gekonów, heloderm)
- żółwi
- węży (Colubridae, Boidae, Elapidae, Viperidae)
Niepublikowane dane podają również izolację pasożytów u krokodyli, scynków i waranów. Niektóre źródła podają że szczególnie wrażliwe na zachorowanie są węże z rodziny Viperidae oraz formy amelanistyczne węży. W większości przypadków izoluję się te pierwotniaki od klinicznie zdrowych osobników w czasie rutynowego badania kału lub podczas sekcji osobników, które padły z innego powodu.
Na zachorowanie szczególnie wrażliwe są osobniki z obniżoną odpornością na wskutek stresu lub innej choroby. Do zarażenia dochodzi drogą alimentarną poprzez bezpośredni kontakt z chorymi osobnikami, lub zabrudzony sprzęt. U węży pierwotniaki zasiedlają błonę śluzową żołądka a u jaszczurek najczęściej jelito. Odnotowano również obecność Cryptosporidium sp. w żołądku u kameleonów, w kloace u felsumy zielonej (Phelsuma madagascariensis grandis) oraz w przewodzie słuchowym i nerce u legwana zielonego (Iguana iguana) (10).
Choroba może przebiegać w dwóch postaciach:
- 1. Subklinicznej – brak objawów klinicznych ale występuje siestwo oocyst.
- 2. Klinicznej
- a. u węży u których inwazja obejmuje żołądek obserwuje się (9, 10, 12):
- spadek masy ciała
- anoreksje
- wymioty 3 – 4 dni po posiłku
- obecność twardego, spuchniętego tworu w środkowej części ciała
- osowienie
- śmierć
- b. u jaszczurek u których inwazja obejmuje najczęściej jelito obserwuje się (9, 10, 12):
- biegunkę
- spadek masy ciała (u gekonów zanik tłuszczu podskórnego w nasadzie ogona)
- anoreksję
- osowienie
- śmierć
Diagnostyka
W diagnostyce do badań wykorzystujemy (5):
- próbki kału
- popłuczyny z żołądka
- wymazy z kloaki
- śluz pokrywający zwymiotowane treści z żołądka
- surowicę
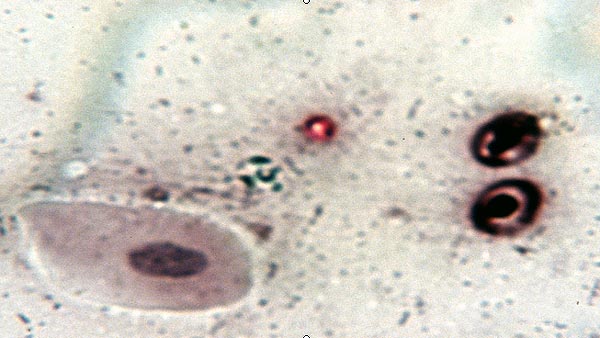
Do badań kału możemy wykorzystywać zarówno świeżą próbkę jak i utrwaloną i przechowywaną w 10% formalinie lub K2Cr2O7. Z próbki kału wykonujemy od razu rozmaz (DWS) lub poddajemy ją flotacji (NaCl, ZnCl, lub metodą Sheathers’a). Uzyskany rozmaz można oglądać pod mikroskopem niebarwiony (UDWS) (skuteczne tylko przy bardzo intensywnych inwazjach). Skuteczność tej metody szacowana jest na 21%. W przypadkach mniej oczywistych stosujemy zmodyfikowane barwienie metodą Ziehl – Nielsena (Mod AFS DWS) (19), wykorzystując kwasooporność oocyst.
Schemat barwienia (6):
- 1. Wykonujemy rozmaz, suszymy i poddajemy utrwaleniu w metanolu przez 10 sek.
- 2. barwimy w fuksynie karbolowej przez 5 min. (4g fuksyny karbolowej + 25 ml 99% alkoholu etylowego + 12 ml fenolu + 25 ml glicerolu + 25 ml DMSO + 75 ml wody destylowanej)
- 3. suszymy przez 10-30 sek.
- 4. odbarwianie przez 1 min. w odbarwiaczu (220 ml zieleni malachitowej + 30 ml kwasu octowego lodowatego 99,5% + 50 ml glicerolu)
- 5. oglądamy pod imersją
W obrazie oocysty są jasnoróżowe wielkości 4 – 5µm z typową wewnętrzną wakuolą, a tło jest niebiesko-zielone. Dzięki barwieniu można odróżnić oocysty od komórek drożdży i leukocytów, które nie są kwasooporne i barwią się na niebiesko, oraz od erytrocytów które są wprawdzie częściowo kwasooporne i wybarwiają się na kolor brązowo – czarny (6). Czułość tej metody jest oceniana na 45 – 59% (19, 21), przy ilości oocyst 3.0 x 104/g, przy mniejszej koncentracji oocyst wyniki są fałszywie ujemne.
W przypadkach wątpliwych lub we wczesnych stadiach chorobowych gdy kontaminacja kału oocystami jest niewielka stosuje się techniki immunofluorescencji . Wykorzystuje się MERIFLUOR™ Cryptosporidium/Giardia – test fluorescencyjny przeciwciał monoklonalnych (mAb). Test ten został zaprojektowany do wykrywania oocyst Cryptosporidium parvum w kale u ssaków. Udowodniono jednak, że test ten jest również skuteczny do wykrywania oocyst Cryptosporidium serpentis w kale węży (19). Technika ta jest 16x czulsza od metod konwencjonalnych i pozwala na wykrywanie oocyst już przy ilości 4,7 x 103 oocyst/ml (19), a skuteczność metody oceniana jest na 100% przy flotacji i na 88% przy DWS (19). Metoda ta wymaga jednak zastosowania do interpretacji wyników mikroskopu immunofluorescencyjnego co wyraźnie zmniejsza jej dostępność do rutynowych badań w lecznicach weterynaryjnych.
W stadiach subklinicznych choroby lub gdy nie możemy uzyskać próbki kału do badania wykorzystujemy (20):
- wymazy z kloaki – wymaz wykonujemy za pomocą bagietki z watą, a uzyskany tą metodą materiał rozprowadzamy na szkiełku podstawowym wykonując rozmaz.
- popłuczyny z żołądka – płukanie żołądka przeprowadzamy poprzez podanie za pomocą sondy 0,9% NaCl w objętości 2% masy węża. Następnie za pomocą 20 ml strzykawki aspirujemy popłuczyny. Metodą tą udaje się otrzymać objętość popłuczyn równą 50% podanego płynu. Uzyskane popłuczyny poddajemy wirowaniu 7500g przez 15 min (6). Supernatant zlewamy, a z osadu wykonujemy rozmaz. W przypadku braku możliwości odwirowania popłuczyn, a ich ilość jest duża możemy pozostawić je na noc w temperaturze 4°C i wykonać rozmaz z uzyskanego tą metodą osadu.
Do badania materiału wykorzystujemy barwienie AFS DWS lub mAb. Czułość tego badania dla AFS DWS wynosi 95% dla próbek z żołądka (5 % fałszywie ujemnych) i 57% dla próbek z kloaki (43% fałszywie ujemnych).Tak wysoka czułość metody uzyskiwana jest dzięki temu że w trakcie barwienia, tkanki błony śluzowej żołądka stają się przeźroczyste co umożliwia zaobserwowanie jasno czerwonych oocyst nawet w wielowarstwowych preparatach. W przypadku mAb czułość wynosi 100% dla próbek z żołądka (20). W związku z małą różnicą w skuteczności pomiędzy AFS DWS i mAb, względy ekonomiczne skłaniają do badań popłuczyn z żołądka poprzez barwienie metodą Ziehl – Nielsena.
Badanie próbek z żołądka skraca wyraźnie okres kwarantanny do 4 tyg., w przypadku badania kału metodą AFS DWS wymaganych jest co najmniej 7 badań (biorąc pod uwagę częstotliwości oddawania kału przez węże co 6 – 33 dni) okres kwarantanny wynosi od 6 tygodni do 8 miesięcy (20).
Udowodniono, że karmienie węża na 3 dni przed płukaniem żołądka wyraźnie zwiększa ilość oocyst w badanej próbce (20). W przypadku wymazów z kloaki nie zaobserwowano wyraźnej zmiany w ilości oocyst.
Należy pamiętać, że testy AFS DWS i mAb nie są różnicujące dla oocyst Cryptosporidium parvum i Cryptosporidium serpentis i wyniki dodatnie mogą być fałszywe i wynikać z zanieczyszczenia pokarmu Cryptosporidium parvum.
W diagnostyce wykorzystać można również śluz pobrany ze zwymiotowanych resztek pokarmu. Poprzez wykonanie rozmazu lub odcisku. Z badanym materiałem postępujemy podobnie jak we wcześniej opisanych przypadkach – stosujemy AFS DWS lub mAb.
Również techniki obrazowania znajdują swoje zastosowanie w diagnostyce, szczególnie RTG żołądka z kontrastem oraz USG.
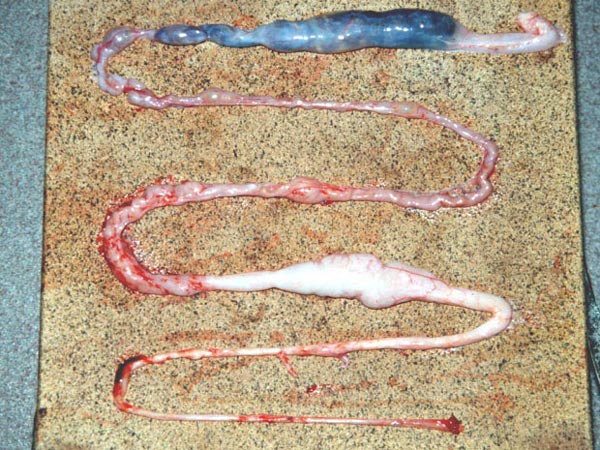
W przypadku gdy mamy zwłoki martwego osobnika lub poddamy zwierzę eutanazji należy wykonać sekcję. W czasie sekcji u węży obserwowano następujące zmiany anatomo – patologiczne (5):
- powiększenie żołądka
- redukcja światła żołądka
- błona śluzowa żołądka może być obrzęknięta, z widocznymi wybroczynami, krwawieniami i ogniskami martwicy
- zagęszczenie śluzu
- silne powiększenie fałdów podłużnych żołądka do których przylega obficie śluz
W badaniach histopatologicznych można zauważyć wewnątrz komórek nabłonka błony śluzowej żołądka pasożyta we wszystkich stadiach rozwojowych, ponadto obserwuje się hipertrofie gruczołów żołądkowych i nacieki zapalne.
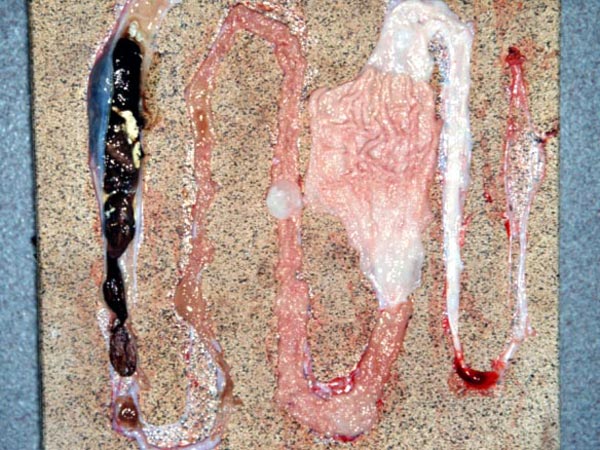
W czasie sekcji u jaszczurek (gekonów lamparcich Eublepharis macularius) obserwowano następujące zmiany anatomo – patologiczne (10):
- średnia masa sekcjonowanego gekona 26,5 g (18,6 – 34,7g)
- całkowity zanik tłuszczu podskórnego u nasady ogona
- zanik lub zmniejszenie ilości tłuszczu w jamie ciała
- zaczerwienienie błony surowiczej jelita cienkiego
- pogrubienie ściany jelita cienkiego
- przekrwienie i sfałdowanie błony śluzowej jelit
- jelito grube niezmienione, wypełnione biało – brązowym płynnym kałem
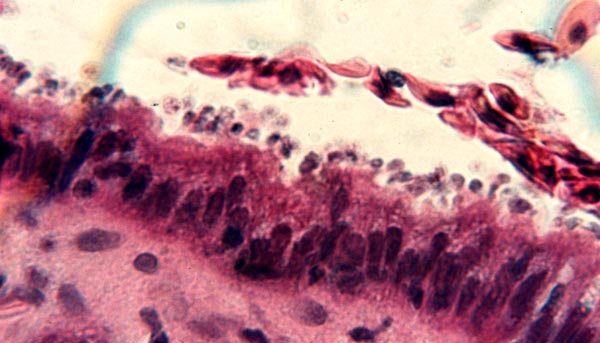
W obrazie histologicznym stwierdzono u większości gekonów niewielką ilość pierwotniaków niejednolicie rozmieszczonych pomiędzy kosmkami jelitowymi. W pojedynczych przypadkach obserwowano dużą ilość pierwotniaków, które pokrywały całą powierzchnię kosmków jelitowych. Obecność pierwotniaków w jelicie prowadzi do zmian hiperplastycznych w obrębie warstwy enterocytów. Obserwowane zmiany hiperplastyczne mogą być słabe, średnie lub silne. U zdrowych gekonów lamparcich nabłonek wyścielający błonę śluzową jest zbudowany z jednej warstwy enterocytów spoczywających na błonie podstawnej. Przy słabych zmianach hiperplastycznych dochodzi do podwojenia warstwy enterocytów, a przy silnej hiperplazji nabłonka obserwuje się 5-10 warstw enterocytów lub więcej. Hiperplastyczne enterocyty są powiększone, z pęcherzykowym jądrem i kwasochłonnymi jąderkami. Kosmki jelitowe mogą być wydłużone lub skrócone i zcieńczone. Błona śluzowa nacieczona jest przez jednojądrowe komórki zapalne, głównie limfocyty (10).
Leczenie
U gadów w przeciwieństwie do ssaków nie dochodzi do samowyleczenia (11, 19). Pomimo wielu badań nie odnaleziono skutecznego leku przeciwko Cryptosporidium sp. wiele leków przeciw kokcydiom i przeciwpasożytniczych jest w przypadku kryptosporidiozy bezużytecznych (5, 7, 17). W terapii stosowano wiele różnych leków:
- Halofuginon i spiramycyna – 160 mg/kg/10 dni redukuje ilość oocyst w kale, ale nie eliminuje infekcji. Dodatkowo halofuginon ma silne działanie hepato- i nefrotoksyczne (5)
- Trimetoprim/Sulfametoksazol i Trimetoprim/Sulfadiazyna – 30 – 60mg/kg/14 dni, a później 1 – 3 razy w tygodniu przez kilka miesięcy likwiduje oocysty w kale, ale biopsje żołądka takich zwierząt dalej dają wynik (+) (5, 17)
- Paromycyna – 100mg/kg/7 dni a później 2 razy w tygodniu przez 3 miesiące (5) lub 300 – 360mg/kg co 2 dni przez 2 tygodnie i powtórka po 6 miesiącach. Terapia taka przeprowadzona u heloderm dała zatrzymanie wydalania oocyst w kale na rok.
- HBC (Hyperimmune bovine colostrum) – Stosowanie HBC dało jak na razie najbardziej obiecujące wyniki. Podając dożołądkowo w ilości 1% wagi węża, uzyskano zmniejszenie liczby oocyst poniżej czułości mAb lub ich okresowy brak w kale. Dodatkowo kilkukrotne podawanie HBC w odstępie tygodnia doprowadziło do cofania się patologicznych zmian w żołądku u przewlekle chorych węży. Badania te dowodzą przydatności HBC w profilaktyce i wspomaganiu leczenia kryptosporidiozy (17). W/w terapie przeprowadzono również u gekonów (Eublepharis macularius) (22), uzyskano również pozytywne wyniki (zmniejszenie ilości oocyst w kale (22) oraz zmniejszenie śmiertelności ze 100% do 42%), jednakże terapia nie była już tak skuteczna jak u węży (wynikać to może z faktu utraty aktywności immunologicznej HBC w jelicie po przejściu przez żołądek (16)), jednocześnie początkowa utrata masy chorego gekona większa niż 25% masy zdrowego gekona powodowała, że uzyskane wyniki leczenia były gorsze. HBC testowano również u warana stepowego (Varanus exanthematicus). Wyniki okazały się o wiele bardziej zadawalające niż u gekonów lamparcich. Okazało się że oocysty Cryptosporidium sp. izolowane z kału waranów reagują z przeciwciałami monoklonalnymi klasy Ig G anty – Cryptosporidium parvum, a izolowane od gekonów nie reagują. Z tego powodu terapia u waranów jest skuteczniejsza i eliminuje zarażenie. (16)
Profilaktyka
W związku z brakiem skutecznego i sprawdzonego preparatu przeciwko Cryptosporidium, bardzo ważna staje się profilaktyka. Wszystkie nowo wprowadzane zwierzęta powinny zostać poddane kwarantannie 30-to, a najlepiej 90–cio dniowej, z wielokrotnymi badaniami kału w tym okresie. Podstawowym środkiem zapobiegawczym jest minimalizowanie stresu i niedopuszczanie do wystąpienia innych chorób (infekcje górnych dróg oddechowych, robaczyce). Rutynowo należy u wszystkich osobników kilka razy w roku badać kał, szczególnie w okresach zwiększonego stresu. Jeżeli u któregoś osobnika pojawi się podejrzenie kryptosporidiozy należy go odizolować i poddać kwarantannie (z ewentualnym jednoczesnym leczeniem) lub eutanazji. Należy bezwzględnie przestrzegać zasad czystości: regularnie usuwać wszelkie organiczne zanieczyszczenia, a klatki i sprzęt dezynfekować (5). Przeciwko oocystom Cryptosporidium sp. skuteczne są tylko dwa środki dezynfekujące: 10% formalina i 5% amoniak, likwidują one zaraźliwość oocyst w temp. 4°C po 18h (5). Oocysty niszczy też wysoka temperatura 45-60°C w ciągu 5-9 min. W temperaturze 4°C oocysty mogą przetrwać 2 – 6 miesięcy (5). W czasie obsługi zwierząt należy zachować zasadę najpierw zdrowe, a później chore, jednocześnie stosując osobny sprzęt dla obu grup.
Poważnym problemem pozostaje fakt czy Cryptosporidium serpentis izolowany od gadów jest zagrożeniem dla ludzi. Udowodniono, że Cryptosporidium muris, parvum, wrairi, baileyi i meleagridis po zarażeniu per os węży nie wywołują u nich stanu klinicznego ani subklinicznego choroby(13, 15, 18). Podobnie zbadano, że Cryptosporidium serpentis nie przenosi się na płazy i ssaki (13, 14). Wyżej wymienione badania pozwalają przypuszczać, że Cryptosporidium serpentis jest dla ludzi niegroźny, ale dla potwierdzenia tego przypuszczenia należy poczekać na wyniki kolejnych badań. Problemem może być jednak fakt, że w przypadku podania wężom myszy zarażonych Cryptosporidium parvum, w kale tych węży można odnaleźć oocysty Cryptosporidium parvum, które są zaraźliwe dla ssaków (w tym ludzi) (9, 13). Stopień zaraźliwości takich przepasażowanych oocyst nie został jeszcze dokładnie zbadany (13), jednakże należy pamiętać o zachowaniu podstaw higieny w czasie obsługi węży.
Chciałbym podziękować Panu profesorowi Tadeuszowi K. Graczykowi z Department of Environmental Health Sciences, Johns Hopkins Bloomberg School of Public Health, Baltimore, MD USA za udostępnienie materiałów (publikacji i zdjęć) pomocnych w przygotowaniu niniejszego artykułu oraz konsultację merytoryczną.
Opracowanie i źródła informacji
Lek. wet. Michał Polok
Bibliografia.
1. http://www.wsse.krakow.pl/pages/wsse_document.php?nid=505&did=2347
2. http://bioweb.usc.edu/courses/2001-spring/documents/bisc419-pres_dkim.pdf
3. http://www.k-state.edu/parasitology/basicbio
4. http://www.k-state.edu/parasitology/taxonomy
5. http://www.veterinaria.uchile.cl/publicacion/congresoxi/prafesional/exo/5.doc
6. Douglas R. Mader, Reptile medicine and surgery 2nd edition, Elsevier Saunders, 2006
7. http://www.avianbiotech.com/Diseases/Cryptosporidium.htm
8. http://www.anapsid.org/cryptosporidium.html
9. http://www.indigosnakes.com/Reptilian%20Crypto.htm
10. http://www.vet.uga.edu/ivcvm/2000/Terrell/Terrell.htm
11. http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=348785
12. http://www.drgecko.com/protozoans.htm
13. Thaddeus K. Graczyk, Ronald Fayer, Michael R. Cranfield, Cryptosporidium parvum is not transmissible to fish, amphibians or reptiles., J. Parasitol., 82(5) 1996, p. 748 – 751
14. Thaddeus K. Graczyk, Michael R. Cranfield, M. E. Angel Geitner, Multiple Cryptosporidium serpentis oocyst isolates from captive snakes are not transmissible to amphibians., J. Parasitol., 84(6) 1998, p. 1298 – 1300
15. Thaddeus K. Graczyk, Ronald Fayer, Michael R. Cranfield, Cryptosporidium parvum is not transmissible to fish, amphibians or reptiles., J. Euk. Microbiol., Vol 43, No. 5, September – October 1996
16. Thaddeus K. Graczyk, Michael R. Cranfield, Eileen F. Bostwick, Successful hyperimmune bovine colostrum treatment of savanna monitors (Varanus exanthematicus) infected with Cryptosporidium sp., J. Parasitol., 86 (3) 2000, p. 631 – 632
17. Thaddeus K. Graczyk, Michael R. Cranfield, P. Helmer, R. Fayer, Eileen F. Bostwick, Therapeutic efficacy of hyperimmune bovine colostrum treatment against clinical and subclinical Cryptosporidium serpentis infections in captive snakes., Veterinary parasitology 74 (1998) 123 – 132
18. Thaddeus K. Graczyk, Michael R. Cranfield, Experimental transmission of Cryptosporidium oocyst isolates from mammals, birds and reptiles to captive snakes., Vet. Res. 29 (1998) 187 – 195
19. Thaddeus K. Graczyk, Michael R. Cranfield, Ronald Fayer, A comperative assessment of direct fluorescence antibody, modified acid – fast stain, and sucrose flotation techniques for detection of Cryptosporidium serpentis oocysts in snake fecal specimens., Journal of Zoo Wildlife Medicine 26(3): 396 – 402, 1995
20. Thaddeus K. Graczyk, R. Owens, Michael R. Cranfield, Diagnosis of subclinical Cryptosporidiosis in captive snakes based on stomach lavage and cloacal sampling., Veterinary parasitology 67 (1996) 143 – 151
21. Thaddeus K. Graczyk, Michael R. Cranfield, Assessment of the conventional detection of fecal Cryptosporidium serpentis oocysts in subclinically infected captive snakes., Vet. Res. (1996) 27, 185 – 192
22. Thaddeus K. Graczyk, Michael R. Cranfield, Eileen F. Bostwick, Hyperimmune bovine colostrum treatment of moribund Leopard gecko (Eublepharis macularius) infected with Cryptosporidium sp., Vet. Res. 30 (1999) 377 – 382
23. http://www.sourcemolecular.com/crypto.htm
Liczba wyświetleń: 6085






















 [7]
[7]