Od kilku lat obserwuje się w kraju wzrost zainteresowania utrzymywaniem w warunkach amatorskich rozmaitych gatunków gadów. Szczególne zainteresowanie tą grupą zwierząt, a wśród nich żółwiami, wyraźnie się nasiliło wraz ze zniesieniem ograniczeń w międzynarodowym ruchu turystycznym, tj. od początku lat dziewięćdziesiątych. Od tego czasu do kraju zaczęły napływać tysiące żółwi, jaszczurek i węży głównie z byłych republik azjatyckich Związku Radzieckiego, a ponadto z Czech, Słowacji, Niemiec oraz krajów basenu Morza Śródziemnego. Najchętniej kupowanymi gadami są bez wątpienia azjatyckie żółwie lądowe z gatunku żółw stepowy (Testudo horsfieldii) oraz żółwie wodno-lądowe z gatunku żółw czerwonolicy (Trachemys scripta elegans) (4) . Oba gatunki to najczęściej oferowane gady w większości sklepów zoologicznych w Polsce. Są też spośród gadów najczęściej spotykanymi pacjentami lecznic weterynaryjnych.
Obecność w sklepach zoologicznych dużej liczby żółwi stepowych, biorąc pod uwagę trudności w rozmnażaniu tego gatunku w warunkach niewoli, nasuwa przypuszczenie, że zostały one odłowione z środowiska naturalnego bytowania i przywiezione do Polski nielegalnie. Od początku lat dziewięćdziesiątych Ministerstwo Ochrony Środowiska nie wydało ani jednego pozwolenia na oficjalny wwóz żółwi stepowych na obszar naszego kraju. Zgodnie z załącznikiem nr 2 Konwencji Waszyngtońskiej ten gatunek żółwia wraz z innymi przedstawicielami rodziny Testudinidae został uznany za zagrożony a handel okazami tego gatunku ma być poddany ścisłej reglamentacji (16).
Żółw czerwonolicy z kolei jest jednym z nielicznych gadów hodowanych z powodzeniem w tzw. „żółwich fermach” znajdujących się między innymi na południu Stanów Zjednoczonych. Większość osobników żółwi ozdobnych znajdujących się w sprzedaży pochodzi właśnie z takiego źródła przechodząc wcześniej przez giełdy zoologiczne w Europie Zachodniej a także w Czechach.
Celem podjętych badań było określenie stanu zdrowotnego oraz składu mikroflory i parazytofauny przewodu pokarmowego u najczęściej spotykanych w krajowym handlu zwierząt i hodowlach amatorskich – lądowych żółwi z gatunku żółw stepowy (Testudo horsfieldii) oraz wodno-lądowych z gatunku (Trachemys scripta elegans). Badania te, realizowano w aspekcie poznania ewentualnych zagrożeń dla hodowców, jak też ustalenia przyczyn wysokiej śmiertelności żółwi utrzymywanych w niewoli w zróżnicowanych warunkach środowiskowych.
Ogółem badaniami klinicznymi objęto 1100 żółwi w tym 650 żółwi stepowych i 450 żółwi czerwonolicych zakwalifikowanych do czterech grup w zależności od środowiska występowania.: giełdy zoologiczne, sklepy zoologiczne, kolekcje prywatne, ogrody zoologiczne. Dokonano wnikliwej oceny warunków utrzymania żółwi w w/w środowiskach w aspekcie ich stresogenngo oddziaływania na zwierzęta zmiennocieplne określając je jako nieodpowiednie, z wyjątkiem terrariów ogrodów zoologicznych oraz nielicznych kolekcji prywatnych. Analizę przeprowadzano na podstawie szczegółowego wywiadu z właścicielami zwierząt oraz przeglądu warunków chowu w miejscu bytowania zwierząt. Ocenie poddano podstawowe parametry środowiska tj. dostosowanie temperatury otoczenia do wymagań gatunkowych, stabilność temperatury otoczenia, prawidłowość urządzenia zbiornika hodowlanego (lądowego, wodno-lądowego) z uwzględnieniem potrzeb bytowych zwierząt, jakość żywienia oraz występowanie innych niekorzystnych czynników środowiska zewnętrznego (2, 7, 8, 15). Oceniając warunki środowiskowe zwierząt na terenie giełd zoologicznych oraz w sklepach zoologicznych zwrócono uwagę na:
1. nadmierne stłoczenie żółwi w zbiornikach transportowych,
2. narażenie zwierząt na działanie niestabilnych warunków otoczenia,
3. możliwość wzajemnego zakażania i zarażania zwierząt w pojemnikach transportowych.
Badania kliniczne żółwi przeprowadzono opierając się na szczegółowym wywiadzie, obserwacji i oględzinach zwierząt (9, 10, 11). Wyniki badań wyrażono według kryteriów zawartych w tabeli 1.
Tabela 1. Ocena punktowa stanu klinicznego pobieranych do badań żółwi.
| Wyszczególnienie | Ocena | |||||
| Bardzo dobra | Pkt. | Dobra | Pkt. | Zła | Pkt. | |
| Ruchliwość | Unoszą ciało nad podłożem. | 2 | Posuwają pancerz po podłożu. | 1 | Apatyczne, brak ruchu. | 0 |
| Stan powiek | Oko otwarte, brak obrzęku powiek. | 2 | Lekki wyciek surowiczy , nieznaczny obrzęk. | 1 | Zalepiona włóknikiem szpara powiekowa, silny obrzęk powiek. | 0 |
| Skóra i wytwory skóry | Zachowana ciągłość, prawidłowa ilość i budowa łusek, brak ran, otarć, blizn, zmian barwy. | 2 | Widoczne blizny, utrata łusek, płatowe zrzucanie naskórka, otarcia. | 1 | Rany, otarcia, uogólnione zrzucanie naskórka, wi-doczne zmiany barwy, utrata łusek. | 0 |
| Otwory nosowe | Suche, nie zalepione, symetryczne. | 2 | Lekki wysięk surowiczy z nozdrzy. | 1 | Silny wysięk ropny z nozdrzy, zalepienie. | 0 |
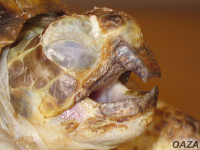
| Błona śluzowa jamy dziobowej | Wolna od ubytków, nalotów, barwy różowej. | 2 | Śluz w jamie dziobowej, przekrwienie bł. śluzowej. | 1 | Duża ilość ciągliwego śluzu, ubytki bł. śluzowej, martwica, naloty włóknika. | 0 |
| Kształt pancerza | Kształt odpowiedni dla gatunku, brak uszkodzeń, otarć, blizn, łuski stabilnie przytwierdzone do podłoża, brak zmiany barwy. | 2 | Zmiany krzywicze nieznacznego stopnia, stare blizny, ubytek pojedynczych łusek. | 1 | Silne zniekształcenia, „świeże” uszkodzenia, pęknięcia, ubytek wielu łusek, widoczne zmiany barwy. | 0 |
| Elastyczność pancerza (dorosłe) | Brak elastyczności. | 2 | Nieznaczna elastyczność. | 1 | „Miękki pancerz”. | 0 |
| Kondycja* | Bardzo dobra | 2 | Dobra | 1 | Zła | 0 |
*Kondycję określano poprzez umieszczenie zwierząt w zawieszeniu za przednie kończyny pomiędzy kciukiem i palcem wskazującym badającego. Stan bardzo dobry określa tu długotrwałe unoszenie się żółwia wraz z chęcią uwolnienia, stan dobry to utrzymywanie się w opisanej pozycji przez kilka minut, zaś ocena zła to brak możliwości utrzymania ciała pomiędzy palcami badającego.
Próby do badań bakteriologicznych i mikologicznych, wykonanych według metodyki opisanej przez Mader’a (15) (wymazy z kloaki) pobrano od 160 żółwi, po 20 z każdej grupy po uprzednim badaniu uznającym zwierzęta za klinicznie zdrowe. Wykonano 60 badań parazytologicznych indywidualnych prób kałowych pobranych od żółwi stepowych oraz 30 badań zbiorczych prób kałowych pobranych z terrariów ogrodów zoologicznych w Warszawie, Poznaniu i Wrocławiu (17).
Badaniom sekcyjnym ( 13, 15) połączonym z badaniami cytologicznymi odcisków narządów wewnętrznych (wątroba, śledziona, płuca, nerki), badaniami bakteriologicznymi i mikologicznymi próbek narządów wewnętrznych oraz badaniami bakteriologicznymi, mikologicznymi i parazytologicznymi treści izolowanych odcinków przewodu pokarmowego (przełyk, żołądek, dwunastnica, okrężnica) poddano 40 żółwi stepowych oraz 29 żółwi czerwonolicych. Dla izolowanych i zidentyfikowanych szczepów bakterii wykonano oznaczenie antybiotykooporności (12) przy użyciu 13 rodzajów krążków antybiotykowych.
Wyniki badań bakteriologicznych zawiera tabela 2 i 3 .
Tabela 2. Procentowy skład flory bakteryjnej przewodu pokarmowego żółwi stepowych.
| Gatunek drobnoustroju | % zakażonej populacji żółwi stepowych |
| Escherichia coli | 87,50 |
| Corynebacterium spp. | 52,50 |
| Candida albicans | 31,25 |
| Citrobacter freundii | 30,00 |
| Salmonella enteritidis | 28,75 |
| Staphylococcus epidermidis | 28,75 |
| Proteus vulgaris | 25,00 |
| Streptococcus gr. viridans | 15,00 |
| Enterobacter amnigenus | 13,75 |
| Proteus mirabilis | 13,75 |
| Staphylococcus intermedius | 10,00 |
| Klebsiella pneumoniae | 8,75 |
| Klebsiella oxytoca | 7,50 |
| Pseudomonas aeruginosa | 6,25 |
| Salmonella typhimurium | 6,25 |
| Staphylococcus aureus | 6,25 |
| Enterococcus faecalis | 4,00 |
| Enterobacter cloacae | 3,75 |
| Streptococcus spp. | 3,75 |
| Aspergillus flavus | 2,50 |
| Flavobacterium sp. | 2,50 |
| Serratia liquefaciens | 2,50 |
| Acinetobacter lwoffi | 1,25 |
| Aeromonas hydrophila | 1,25 |
| Aeromonas veronii var.sobria | 1,25 |
| Aspergillus niger | 1,25 |
| Geotrichum spp. | 1,25 |
| Hafnia alvei | 1,25 |
| Micrococcus spp. | 1,25 |
| Nocardia spp. | 1,25 |
| Penicillum spp. | 1,25 |
| Rodotorula rubra | 1,25 |
Tabela 3. Procentowy skład flory bakteryjnej przewodu pokarmowego żółwi czerwonolicych
| Gatunek drobnoustroju | % zakażonej populacji żółwi czerwonolicych |
| Citrobacter freundii | 66,25 |
| Candida albicans | 46,25 |
| Salmonella enteritidis | 40,00 |
| Escherichia coli | 40,00 |
| Aeromonas hydrophila | 35,00 |
| Klebsiella oxytoca | 21,25 |
| Proteus vulgaris | 17,50 |
| Proteus mirabilis | 16,25 |
| Salmonella typhimurium | 11,25 |
| Corynebacterium sp | 11,25 |
| Pseudomonas fluorescens | 11,25 |
| Streptococcus intermedius | 10,00 |
| Pseudomonas aeruginosa | 10,00 |
| Aeromonas veronii var. sobria | 8,75 |
| Serratia liquefaciens | 5,00 |
| Providentia rettgeri | 5,00 |
| Rodotorula rubra | 5,00 |
| Enterobacter amnigenus | 3,75 |
| Salmonella typhimurium | 3,75 |
| Providentia stuarti | 2,50 |
| Serratia odorifera | 2,50 |
| Aspergillus fumigatus | 2,50 |
| Morganella morgani | 2,50 |
| Providentia stuartii | 2,50 |
| Staphylococcus epidermidis | 2,50 |
| Pseudomonas fluorescens | 1,25 |
| Streptococcus ß-hemolityczny | 1,25 |
| Enterococcus faecalis | 1,25 |
| Salmonella sp. typ CO | 1,25 |
Na szczególną uwagę zasługuje stosunkowo częste diagnozowanie u badanych zwierząt bezobjawowego nosicielstwa pałeczek Salmonella enteritidis i Salmonella typhimurium.
Badanie parazytologiczne prób kałowych wykazały obecność endopasożytów z rodziny Oxyuroidea (Tachygonetria robusta i Tachygonetria lobata) u 100% żółwi stepowych w środowisku giełdy zoologicznej, 75% w środowisku sklepów zoologicznych i 50% w środowisku kolekcji prywatnych. Badania wykazały obecność jaj endopasożytów w 60% prób zbiorczych z terrariów ogrodów zoologicznych.
Badania parazytologiczne treści przewodu pokarmowego żółwi stepowych pobranej śródsekcyjnie wykazały zarażenie endopasożytami 86% populacji zwierząt. Analogicznie w przypadku żółwi czerwonolicych odsetek zarażenia osiągnął wartość 80%. W jednym przypadku w badaniu parazytologicznym treści przewodu pokarmowego żółwia czerwonolicego odnaleziono dorosłe postacie glist z gatunku Angusticaecum holopterum.
Tabela 4. Procentowe zestawienie zarażeń pasożytami przewodu pokarmowego żółwi stepowych i czerwonolicych z uwzględnieniem miejsca pochodzenia. -badanie koproskopowe.
| Środowisko | Gatunek żółwia | |
| Żółw stepowy % zarażeń | Żółw czerwonolicy % zarażeń | |
| giełdy zoologiczne | 100 | Nie badano |
| sklepy zoologiczne | 75 | Nie badano |
| kolekcje prywatne | 50 | Nie badano |
| ogrody zoologiczne | 60% prób zbiorczych | Nie badano |
Tabela 5. Procentowe zestawienie zarażeń pasożytami przewodu pokarmowego żółwi stepowych i czerwonolicych – badanie sekcyjne.
| Gatunek żółwia | % zarażeń |
| Żółw stepowy | 86 |
| Żółw czerwonolicy | 80 |
W badaniach in vitro antybiotykooporności izolowanych drobnoustrojów spośród ocenianych leków przeciwbakteryjnych najwyższą skutecznością wykazała się neomycyna, enrofloksacyna, streptomycyna i gentamycyna.
Wyniki badań i obserwacji jednoznacznie wykazują istotny wpływ środowiska utrzymywania żółwi stepowych i czerwonolicych na wskaźniki zachorowalności i śmiertelności omawianej grupy zwierząt. Obecność w składzie flory bakteryjnej przewodu pokarmowego drobnoustrojów chorobotwórczych i warunkowo chorobotwórczych, przy zaburzonym funkcjonowaniu układu immunologicznego organizmu, wskazuje na możliwość indukowania endogennych zakażeń posocznicowych u tych zwierząt. Z powodów epidemiologicznych na szczególne podkreślenie zasługuje fakt wykazania obecności w przewodzie pokarmowym żółwi stepowych i czerwonolicych (podobnie jak u innych gatunków gadów) patogennych dla człowieka serowariantów pałeczek Salmonella (1, 2, 6, 7, 14, 18).
Istotną rolę w ograniczaniu niekorzystnych skutków wzrostu zainteresowania posiadaniem w domowym terrarium żółwia czerwonolicego czy stepowego dla zwierząt oraz ich właścicieli ma odpowiednie działanie profilaktyczne w aspekcie zoohigienicznym i weterynaryjnym.
Ograniczenie możliwości zakażenia człowieka w kontakcie z żółwiami uzyskuje się przez rygorystyczne stosowanie niżej wymienionych zasad:
1. żółwie w domu przetrzymywane są w odpowiednio urządzonych terrariach. Niedopuszczalne jest utrzymywanie zwierząt „luzem” tj. podobnie jak w przypadku innych zwierząt domowych np. psa czy kota,
2. nie należy urządzać terrarium w pomieszczeniach, w których przygotowywany jest pokarm (kuchnie, jadalnie),
3. terraria powinny być poddawane systematycznemu oczyszczaniu połączonemu z dezynfekcją zbiornika i urządzeń akwarystycznych (filtry wody, urządzenia grzewcze),
4. nie należy wylewać zanieczyszczonej wody z terrarium do kuchennego zlewozmywaka – syfon jest dobrym miejscem namnażania dla drobnoustrojów,
5. po każdym bezpośrednim kontakcie ze zwierzętami należy bezwzględnie dokładnie umyć ręce.
Weterynaryjne działania profilaktyczne polegają na:
1. organizacji sześciotygodniowej kwarantanny dla nowo pozyskanych zwierząt,
2. cyklicznym (raz w roku) przeprowadzaniu badań mikrobiologicznych wymazów kałowych oraz parazytologicznych badań koproskopowych.
W przypadku stwierdzenia w badaniach mikrobiologicznych stanu bezobjawowego nosicielstwa bakterii chorobotwórczych lub względnie chorobotwórczych (szczególnie Salmonella sp.) celowym wydaje się podanie odpowiedniego antybiotyku. Spośród ocenianych w badaniach własnych leków przeciwbakteryjnych najwyższą skuteczność w świetle przewodu pokarmowego wykazuje neomycyna podawana w formie zawiesiny przy pomocy sondy do żołądka zwierzęcia.
Przy wystąpieniu objawów ogólnych zakażenia organizmu (posocznica) poza neomycyną, redukującą populację drobnoustrojów w obrębie żołądka i jelit, koniecznym staje się dodatkowe podanie antybiotyków drogą parenteralną (i.m., s.c., i.p.). W takich przypadkach najbardziej skutecznymi antybiotykami są enrofloksacyna, gentamycyna, streptomycyna i amikacyna.
Jarosław Zajączkowski
Piśmiennictwo
1. Ackman D., Drabkin P., Birkhead B., Cieślak P.: „Reptila-associated Salmonellosis: a case -control study (Abstract). In program and abstracts of 34th Intersciense Conference on Antimicrobial Agents and Chemotherapy”. Washington DC American Society of Microbiology, 1994.
2. Aeppel T.: „Microbiologist Looks for Ways To Rid Turtles of Salmonella”. The Wall Street Journal. V 30, 1996
3. Center for Disease Control Salmonella Surveillance: Annual Summary a) 1965, b)1969 Report 85 and 87, c) 1970 Report 97, d) 1971 Report 105.
4. Cogger H.G., Zweifel R.G.: Gady i płazy, Elipsa, Warszawa 1993, s 108-125.
5. Cooper J.F, Hutchison M.F., Jackson O.F., Maurice R.J.: Manual of exotic Pets, BSAVA 1985, s. 142-160.
6. Dalton C., Hoffman R., Pape J.: „Iguana -associated salmonellosis in children.” Periatr. Infect. Dis. J. 1995: 14:319-320.
7. Fafiński Z.: Salmonelozy gadów Materiały Sesji Naukowej Puławy 17-18.06.1998 PTNW, Sekcja Patologii Zwierząt Nieudomowionych., ss. 38-41.
8. Fröhlich F.: „Wunderschöne Schmuckschildkröten” , Franckh – Kosmos Verlag – GmbH ” Co. Stuttgart 1995, s. 6-19.
9. Gabrich K., Zwart P.: „Krankheiten der Heimtiere”, III Aufl. Schlütersche 1995, s. 662-751
10. Gobel Th., Schlidger B.J.: Propadeutik und diagnostische Verfahren bei Reptilien. Prakt. Tierarzt 3, 14 – 25
11. Jacobson E.J: „Biology and Diseases of Reptiles. Laboratory Animal Medicine.” San Diego, Academic Press, 1984, pp 449 – 476.
12. Jacobson E.J.: „Zastosowanie antybiotyków w leczeniu chorób zakaźnych gadów”, Magazyn Weterynaryjny, Vol. 6, Warszawa 1996, s. 30.
13. Keymer I.: „Diseases of the chelonias: necropsy survey of terrapins and turtles”. Vet. Rec. 103: 577, 1978.
14. Lamm S.H.: „Turtle – associated salmonellosis.” I. An. Estimation of the magnitude of the problem in the United States.” An.J.Epidemid. 517,1970-1971,s. 511-517.
15. Mader D.R.: „Reptile Medicine and Surgery”, W.B. Saunders Co. Philadelphia 1996. S. 117-125.
16. Steciak J.: „Zbiór przepisów dotyczących odpraw celnych towarów objętych pozaekonomicznymi ograniczeniami obrotu z zagranicą wprowadzonych ze względu na:ochronę zdrowia ludzkiego, ochronę zwierząt i roślin, ochronę dóbr kultury.” Główny Urząd Ceł, Departament Polityki Kadrowej i Szkolenia, Warszawa 1991, s. 174-245.
17. Stefański W., Żarnowski E. „Rozpoznawanie inwazji pasożytniczych u zwierząt” Warszawa 1971, s.27-29.
18. Zaremba M.L., Borowski J.: „Mikrobiologia lekarska dla studentów medycyny” PZWL 1997.
Liczba wyświetleń: 3938






















 [6]
[6]